Sostanza naturale
Prodotti naturali ( prodotto naturale inglese in) denota Chimica un composto derivato da organismi che si forma per soddisfare le funzioni biologiche; un sinonimo moderno di sostanza naturale nel senso di chimica è biomolecola . Solo le sostanze pure o le miscele definite di sostanze sono intese come tali. Il legislatore definisce le sostanze organiche mediante l' ordinanza sugli agenti biologici .
Nel linguaggio comune, sostanza naturale è un termine più ampio: tutte le sostanze che gli esseri umani non hanno prodotto artificialmente. Questo articolo si riferisce solo al termine specifico definito sopra nel senso di chimica. Dopodiché, non contano tra le sostanze naturali
- Sostanze complesse e non pure formate da esseri viventi, prodotti naturali come piume , legno o cotone , che sono costituiti da sostanze naturali ma sono miscele di sostanze non uniformi
- tutte le sostanze inorganiche presenti in natura come minerali o rocce
Sebbene una sostanza naturale sia un composto definito, si trova negli organismi in molte modificazioni mutuamente convertibili. La funzione biologica è controllata o controllata dalle modifiche. Dopo l'estrazione e la purificazione, si ottiene solitamente la struttura di base stabile, che può essere assegnata alle classi di sostanze naturali.
Le sostanze naturali si accumulano o si convertono l'una nell'altra in tutti gli organismi viventi. La loro sintesi è associata a un dispendio di energia per l'organismo. I loro compiti sono vari a seconda della classe della sostanza e vanno dal semplice metabolismo o generazione di energia attraverso componenti cellulari e materiali da costruzione dell'organismo a compiti di controllo complessi. Per quanto riguarda le loro funzioni, si può distinguere tra sostanze naturali primarie e secondarie. Le sostanze naturali primarie includono tutti i composti necessari all'organismo per sostenere la vita e la crescita. Tra questi, soprattutto, i grassi ei biopolimeri dei carboidrati e delle proteine . Le sostanze naturali secondarie si formano per ragioni spesso ancora sconosciute e si dividono nelle grandi classi di sostanze terpeni , aromatiche e alcaloidi .
La chimica delle sostanze naturali è una scienza interdisciplinare che può utilizzare metodi di chimica organica e analitica per rispondere a domande di biologia , biochimica , fisiologia e farmacia . La chimica dei prodotti naturali è di grande importanza in farmacologia , nello sviluppo di nuovi principi attivi e in generale nello sviluppo di metodi in queste discipline.
storia
Il termine originale prodotto naturale era determinato dalla definizione storica di chimica organica ; comprendeva la totalità delle sostanze utilizzate nella struttura degli animali e delle piante . Nel 1827, Jöns Jakob Berzelius presumeva, a causa del livello di conoscenza e della complessa struttura chimica delle sostanze naturali, che ci doveva essere una forza vitale ( vis vitalis ) per la loro produzione . La distinzione tra sostanze autogestito e esternamente organizzata è stato rivisto da Friedrich Wöhler (1828), che aveva dimostrato con la sintesi dell'urea che il composto di cianato di ammonio, definita come inorganico, può essere convertito in l' urea composto, che è definito come organico .
Nella definizione odierna, la chimica organica include praticamente tutti i composti del carbonio. Nel corso del tempo, la chimica dei prodotti naturali si è sviluppata in una sotto-area e si occupa dell'isolamento, della delucidazione della struttura , della sintesi o della biosintesi e delle proprietà dei composti che si trovano negli organismi (come animali, piante e microrganismi).
Inizialmente, la chimica dei prodotti naturali si occupava solo di ingredienti di origine vegetale, poiché era molto influenzata dalla farmacognosia (scienza dei farmaci). I composti (inizialmente per lo più alcaloidi ) sono stati isolati da estratti vegetali e sono stati fatti tentativi per chiarire la loro struttura.
A metà del 19 ° secolo, Justus Liebig ha ampliato il concetto di sostanze naturali per includere composti di origine animale. Emil Fischer divenne un pioniere nella delucidazione della struttura e nella sintesi di carboidrati e proteine verso la fine del XIX secolo .
Alla fine degli anni '30, le classi più importanti di sostanze naturali erano state trovate, esaminate e la loro struttura chiarita. I traguardi importanti sono qui:
- Terpeni di Otto Wallach da oli essenziali
- Steroidi di Adolf Windaus e Heinrich Otto Wieland
- Carotenoidi di Paul Karrer
- Coloranti porfini di Richard Willstätter e Hans Fischer
- Vitamine di Paul Karrer , Adolf Windaus , Robert R. Williams , Richard Kuhn e Albert von Szent-Györgyi Nagyrápolt, tra gli altri
- Ormoni di Adolf Butenandt e Edward Calvin Kendall
Con la scoperta della penicillina nel 1940 da parte di Alexander Fleming , Ernst Boris Chain e Howard Walter Florey , anche i microrganismi furono riconosciuti come una fonte redditizia di sostanze naturali.
Dopo la fine della seconda guerra mondiale, la chimica dei prodotti naturali è stata promossa dallo sviluppo di metodi analitici e fisici nuovi e molto potenti. Sia la spettrometria di massa , sia la cristallografia a raggi X e successivamente la spettroscopia NMR hanno permesso possibilità fino ad ora inimmaginabili di determinazione della struttura senza derivatizzazione del prodotto naturale e piccole quantità di analita . Gli unici metodi ora lentamente stabiliti di cromatografia ed elettroforesi hanno permesso di separare le miscele di sostanze con una velocità e una purezza precedentemente irraggiungibili.
Definizione in diritto dei prodotti chimici
Il termine sostanza naturale è legalmente definito come "sostanza presente in natura in quanto tale, non trasformata o trattata solo manualmente, meccanicamente o mediante forza gravitazionale, mediante dissoluzione in acqua, flottazione, estrazione con acqua, distillazione a vapore o riscaldamento per disidratazione o mediante qualsiasi mezzo preso dall'aria " .
Secondo l'allegato V paragrafi 7 e 8 del regolamento REACH (EG 1907/2006), le sostanze naturali sono esentate dalla registrazione se non sono state modificate chimicamente. Ciò non si applica se sono classificati come pericolosi secondo i criteri del regolamento CLP (CE n. 1272/2008), soddisfano i criteri per le sostanze PBT o vPvB o sono altrettanto preoccupanti.
Definizione dell'ordinanza sugli agenti biologici
Secondo il BioStoffV, gli agenti biologici sono essenzialmente microrganismi, strutture proteiche che possono causare malattie e colture cellulari.
"Oltre alla direttiva europea 2000/54 / CE (protezione dei lavoratori contro i rischi da agenti biologici sul lavoro), l' ordinanza sugli agenti biologici stabilisce anche la direttiva europea 2010/32 / UE (prevenzione di lesioni da strumenti taglienti / appuntiti nel ospedale e settore sanitario) nel diritto tedesco sulla protezione del lavoro.
L'ordinanza sugli agenti biologici disciplina le attività lavorative con agenti biologici, cioè in senso lato con microrganismi / agenti patogeni. Contiene norme per la protezione dei dipendenti durante queste attività, i. H. per proteggere dalle infezioni e dagli effetti sensibilizzanti, tossici o altri dannosi per la salute. L'ordinanza sugli agenti biologici divide gli agenti biologici in quattro gruppi di rischio. Su questa base vengono effettuate la valutazione del rischio e la definizione delle misure necessarie. "
Importanza della chimica dei prodotti naturali
farmacologia
Dalla scoperta della penicillina da parte di Alexander Fleming , le sostanze naturali sono diventate un'importante fonte di strutture di piombo per ingredienti farmaceutici attivi. Le sostanze naturali hanno effetti farmacologici come antibiotici , immunosoppressori , inibitori enzimatici , antagonisti e agonisti dei recettori , tossine , agenti antitumorali e antivirali .
Oggi un'intera gamma di principi attivi deriva da sostanze naturali. Oltre agli antibiotici β-lattamici, questo include anche agenti chemioterapici come il paclitaxel dell'albero del tasso del Pacifico ( Taxus brevifolia ) o l' epotilone del myxobacterium Sorangium cellulosum .
I nucleosidi sono stati modificati in modo da poter essere utilizzati come antivirali , come il principio attivo dell'HIV zidovudina .
Secoli di esperienza nella medicina popolare hanno attirato l'attenzione su molte piante e quindi sui loro costituenti come strutture di piombo. Ad esempio, il ginseng ( Panax ginseng ), il ginkgo ( Ginkgo biloba ) o l' albero di neem ( Azadirachta indica ) sono stati a lungo oggetto di intense ricerche.
Le strutture di piombo così ottenute servono come base per l'ottimizzazione farmacologica del principio attivo. Di seguito sono stabilite le relazioni struttura-attività (QSAR) e cerca di ottimizzare le proprietà fisiche come la solubilità nei mezzi acquosi. A questo scopo vengono spesso utilizzate tecniche come la sintesi parallela o la chimica combinatoria .
Le sostanze naturali sono indicate farmacologicamente come strutture privilegiate perché si formano in condizioni fisiologiche e mostrano proprietà farmacocinetiche vantaggiose . Il fatto che circa la metà dei principi attivi più venduti siano sostanze naturali o loro derivati mostra la particolare importanza delle sostanze naturali per la farmacologia.
biologia
La delucidazione delle relazioni fisiologiche è importante per la biologia . Nel campo delle sostanze naturali, ciò include la biosintesi e la funzione biologica negli organismi, sia come enzima , sostanza messaggera che come fornitore o deposito di energia. Le sostanze messaggere includono Ormoni , neurotrasmettitori e feromoni . I fornitori e le riserve di energia sono generalmente grassi, proteine e carboidrati. La biosintesi delle sostanze naturali è tanto diversa quanto la loro varianza nella struttura.
La delucidazione di una via biosintetica richiede spesso un grande sforzo. Vengono utilizzate diverse tecniche:
- Tecnologia isotopica - Le potenziali molecole precursori sono contrassegnate da un isotopo raro, possibilmente radioattivo, ma non a decadimento troppo rapido , come l' isotopo 14 C (emivita 5736 anni). Dopo che è stato introdotto nel metabolismo (ad esempio mediante alimentazione o iniezione), si osserva il destino dell'isotopo nella molecola bersaglio. Da ciò si può dedurre il percorso della biosintesi.
- Tecniche enzimatiche : qui il percorso biosintetico deve essere approssimativamente noto. Si lavora su enzimi isolati o con colture cellulari per studiare percorsi biosintetici in condizioni di laboratorio e non più in vivo .
- Metodi di ingegneria genetica - ad esempio, qui la biosintesi da parte dei batteri viene interrotta con l'aiuto di mutazioni geniche; un intermedio di una sequenza biosintetica si accumula nel processo.
Chimica organica
Per la chimica organica, la chimica dei prodotti naturali rappresenta una sfida in molti modi. Da un lato nell'area della delucidazione della struttura, ovvero dell'analisi: non è raro che diversi gruppi di lavoro lavorino sulla delucidazione della struttura per un periodo di anni . Strutture complesse come B. Azadirachtin ha richiesto diversi tentativi fino a quando è stata dimostrata la struttura corretta. Anche la sintesi totale di un prodotto naturale non sempre dimostra la corretta struttura - come hanno dimostrato l'alcol patchulia e la sintesi di Büchi.
In generale, la sintesi di una sostanza naturale complessa è anche una sfida per la chimica organica. Per acquisire importanza come farmaco , è necessario sviluppare una sintesi totale o parziale per un prodotto naturale . Questo è ancora più importante nel contesto dell'ottimizzazione della struttura, perché migliaia di composti sulla base di una sostanza naturale devono essere sintetizzati per stabilire una relazione struttura-attività e per poter ottimizzare le proprietà farmacologiche. I prodotti naturali sono generalmente composti complessi con centri di chiralità che devono essere costruiti nella configurazione stereochimica desiderata. I reagenti utilizzati devono essere compatibili con i gruppi funzionali nella molecola, oppure deve essere selezionata anche un'appropriata strategia del gruppo protettivo .
La sintesi totale della vitamina B 12 di Robert B. Woodward e Albert Eschenmoser nel 1973, la sintesi della palitossina di Yoshito Kishi nel 1994 o la corsa per la prima sintesi totale del taxolo mostrano quanto può essere lunga e laboriosa una sintesi naturale di un prodotto tra Robert A. Holton , Kyriacos C. Nicolaou e Samuel J. Danishefsky dello stesso anno. La sintesi della vitamina B 12 ha richiesto circa 20 anni di lavoro di sviluppo. A tal fine, è stato necessario sviluppare fasi di reazione completamente nuove e, per la vitamina B 12 , le regole di Woodward-Hoffmann hanno persino creato nuove basi teoriche. Roald Hoffmann è stato insignito del Premio Nobel per il loro sviluppo . Robert B. Woodward aveva già ricevuto un premio nel 1965 per il suo lavoro nel campo della chimica dei prodotti naturali.
Un'altra importanza dei prodotti naturali nella chimica organica è il loro utilizzo come fonte di elementi costitutivi sintetici. Molte sostanze naturali, come B. Gli zuccheri o gli amminoacidi sono composti chirali e possono essere utilizzati come molecole precursori per sintesi chirali o come reagenti. Ma i prodotti naturali possono anche essere semplicemente una fonte di composti di partenza complessi e persino di sintesi industriali. Ad esempio, l'acido shikimico è il materiale di partenza per la sintesi su larga scala del principio attivo influenzale oseltamivir (Tamiflu) di Roche .
Classificazione in base alla funzione biologica
Quando si classificano le sostanze naturali in base alla loro funzione biologica, viene fatta una distinzione tra sostanze naturali primarie e sostanze naturali secondarie . La distinzione risale al premio Nobel Albrecht Kossel .
Oggi questa classificazione è piuttosto arbitraria e storica, ma è ancora utilizzata in letteratura. Questa classificazione è obsoleta sia in termini di struttura chimica che di funzione biologica, in quanto una sostanza naturale può avere sia una funzione di sostentamento vitale nel senso di Kossel, ma può anche avere funzioni classiche di sostanze naturali secondarie (molecole trasmittenti, feromoni, anti- alimentazione, ecc.).
Sostanze naturali primarie
Secondo la definizione di A. Kossel, le sostanze naturali primarie includono tutti i composti necessari all'organismo per il supporto vitale e la crescita. Tuttavia, questa non è una classe strettamente delimitata e le transizioni tra le vie metaboliche primarie e secondarie sono fluide.
Le sostanze naturali primarie si trovano durante lo sviluppo ( crescita ) degli esseri viventi, ma anche durante la scomposizione in molecole più piccole, che possono essere associate ad un guadagno di energia per l'organismo. Questa energia può a sua volta essere utilizzata per costruire altre biomolecole primarie o secondarie. L'accumulo e la degradazione di sostanze naturali sono alla base del metabolismo energetico e di massa di tutti gli organismi.
Sostanze naturali secondarie
Le sostanze naturali secondarie si formano per molte ragioni, ma non sono essenziali per la vita dell'organismo. Come sostanze vegetali secondarie in particolare, rappresentano una grande varietà di strutture chimiche e si formano in quello che è noto come metabolismo secondario. Ciò segue il metabolismo primario e quindi non può avvenire indipendentemente da esso. Tuttavia, il metabolismo secondario non è coinvolto nel metabolismo energetico e non è né parte del metabolismo anabolico (accumulo) né catabolico (demolizione). Le sostanze naturali secondarie si formano solo in speciali tipi di cellule . Le transizioni dai prodotti metabolici primari ai prodotti metabolici secondari sono fluide. La funzione biologica delle sostanze naturali secondarie è molto varia e spesso non nota.
Classificazione in base alla struttura chimica
Quando si classificano le sostanze naturali in base alla loro struttura chimica ( classe di sostanze ), viene fatta una distinzione tra biomolecole e gruppi di biomolecole in base ai loro gruppi funzionali , ad es. H. il loro design strutturale. Nel caso di sostanze naturali si possono trovare sia molecole piccole e semplici come B. steroidi , composti aromatici o acidi grassi , ma anche biopolimeri molto complessi come proteine , DNA e carboidrati . Anche questa classificazione non deve essere considerata assoluta, poiché sostanze composte in modo complesso, ad es. B. una proteina altamente glicosilata ( glicoproteina ), non può essere assegnata a una classe chimica pura di sostanze.
Amminoacidi, peptidi e proteine
Gli amminoacidi proteinogenici sono esclusivamente α-amminoacidi. Tuttavia, anche i β-amminoacidi come la β-alanina, l'acido β-amminobutirrico o l'acido γ-amminobutirrico si trovano naturalmente. Tutti gli α-amminoacidi presenti in natura (ad eccezione della glicina ) sono chirali . Praticamente tutti sono L- amminoacidi.
La sintesi completa di tutti i 20 amminoacidi canonici biogenici può essere trovata solo nei microrganismi e nelle piante. Gli animali, inclusi gli esseri umani, devono assumere alcuni aminoacidi - negli esseri umani questi sono valina , leucina , isoleucina , metionina , treonina , lisina , fenilalanina e triptofano , e nell'infanzia anche la tirosina - come amminoacidi essenziali con il loro cibo. Per i pesci e gli insetti sono essenziali anche l' arginina e l' istidina .
Gli amminoacidi proteinogenici costituiscono la base per tutte le varianti di amminoacidi. Altri amminoacidi come B. L' ornitina o l' omoserina sono presenti nelle proteine e come prodotti metabolici. Altri amminoacidi non proteinogenici sono formati dall'idrossilazione di amminoacidi proteinogenici. Ciò comprende B. 4-idrossiprolina . Si possono trovare anche prodotti di N- metilazione o iodurazione. Alcuni amminoacidi alogenati sono stati trovati nei molluschi . Ad oggi, sono stati identificati un totale di oltre 400 aminoacidi che non sono incorporati nelle proteine. Molti di questi sono formati dall'idrossilazione o metilazione di amminoacidi proteinogenici omologhi. Si trovano negli antibiotici peptidici o come tossine (come nel fungo del tappo della morte ). Amminoacidi rari come canavanina ( Fabaceae ), mimosina ( specie mimosa ) e 2-metileneciclopropilglicina ( Sapindaceae ) agiscono come antagonisti degli amminoacidi strutturalmente correlati arginina , fenilalanina e tirosina o leucina e sono quindi tossici.
Peptidi e proteine
Sia i peptidi che le proteine sono catene di amminoacidi collegati tra loro tramite un legame ammidico . Qui viene fatta una distinzione tra oligopeptidi , peptidi e proteine a seconda del numero di amminoacidi e della massa molare .
| Cognome | Numero di amminoacidi | massa molare |
|---|---|---|
| Oligopeptide | 2-10 amminoacidi | |
| peptide | > 10 a circa 80-90 aminoacidi | |
| proteina | da circa 80-90 amminoacidi | da 10.000 Da o 10 kDa |

La divisione tra peptide e proteina si basa sul fatto che le proteine non possono passare attraverso le membrane di dialisi a causa della loro elevata massa molare . Poiché la massa molecolare delle proteine è abbastanza grande, l'unità di misura comunemente usata qui è il kilodalton (simbolo di unità kDa), che corrisponde alla normale unità di massa usata per atomi e molecole, ma è stata espansa dal prefisso "kilo" ( e quindi di un fattore 10 3 ).
A causa del legame vettoriale di un peptide acilico o di una proteina, viene fatta una distinzione tra le due estremità, il terminale N (l'estremità con un gruppo amminico libero o modificato) e il terminale C (l'estremità con un gruppo carbossilato libero).
I peptidi che si formano solo dagli amminoacidi sono chiamati peptidi omeomerici. I peptidi che contengono anche pseudo amminoacidi sono indicati come peptidi eteromerici. Agli pseudoaminoacidi z. B. acidi idrossicarbossilici calcolati, che interrompono la struttura ammidica alternata di un peptide mediante un legame estereo .
I peptidi ciclici sono anche chiamati peptolidi. A seconda che gli amminoacidi in un peptide siano legati tra loro solo tramite legami ammidici o se ci siano altri legami come i ponti disolfuro , si parla nel primo caso di peptidi omodetici e comunque di peptidi erodetici. Molti peptidi hanno una struttura strettamente lineare, ma ci sono anche peptidi ramificati che si formano per reazioni sulle catene laterali. Le ribonucleasi sono un esempio di peptidi ramificati.
A causa della loro struttura modulare , proteine e peptidi sono molto variabili nelle loro proprietà fisiche e quindi hanno funzioni molto speciali e molto diverse negli organismi . I compiti importanti delle proteine includono agire come enzimi , cioè catalizzano reazioni biochimiche, sono tossine per la difesa contro organismi ostili, sono una parte importante del sistema immunitario , formano strutture corporee come i muscoli e sono molecole trasmittenti.
carboidrati
All'interno dei carboidrati viene fatta una distinzione tra monosaccaridi , oligosaccaridi e polisaccaridi secondo il seguente schema:
| Cognome | Numero di unità monosaccaridiche |
Esempi |
|---|---|---|
| Monosaccaridi | 1 | Glucosio , fruttosio |
| Oligosaccaridi | 2-9 | Saccarosio , maltosio , raffinosio |
| Polisaccaridi | > 10 | Amido , cellulosa |
Nel caso dei polisaccaridi si distingue tra omopolisaccaridi come l'amido, che è costituito da un'unità zuccherina alternata, e gli eteropolisaccaridi, che contengono vari zuccheri.
I carboidrati hanno una varietà di funzioni nell'organismo. Sono un accumulatore di energia, che può essere attivato molto rapidamente, formano l' esoscheletro le artropodi in forma di chitine , come cellulosa sono una componente importante delle pareti cellulari delle piante e con il loro amido sono un accumulatore di energia per piante e quindi anche un importante fornitore di energia per il consumo animale e umano.
Monosaccaridi
I monosaccaridi più comuni sono le aldoesosi e pentosi e le loro varianti 2-cheto. Di questi, il glucosio ha un ruolo centrale e importante nel metabolismo dei carboidrati e quindi anche nel bilancio energetico degli organismi. La scomposizione dei monosaccaridi per la produzione di energia sotto forma di adenosina trifosfato (ATP) è chiamata glicolisi . Ha luogo praticamente in tutti gli organismi nella stessa forma.
Tutti i monosaccaridi sono composti chirali e praticamente tutti i monosaccaridi presenti in natura provengono dalla serie D. Se un gruppo idrossile è stato rimosso nel metabolismo , si parla di zuccheri desossi. Gli zuccheri desossilici sono per lo più dosi deossiliche, che di solito si trovano nei legami glicosidici . Un esempio di questo è il desossiribosio come componente dell'acido desossiribonucleico (DNA). Gli zuccheri desossi ramificati sono anche noti come metillosio e sono importanti come sostanza del gruppo sanguigno o nei glicosidi cardiaci . Si formano nell'organismo attraverso il trasferimento di carbonio o le reazioni di riarrangiamento .
Oltre ai monosaccaridi, che non hanno altri eteroatomi a parte l'ossigeno, gli ammino zuccheri sono importanti. Legati glicosidicamente, fanno parte degli antibiotici, parte della mureina nelle pareti cellulari dei batteri e elementi costitutivi dell'armatura di chitina .
Cladinosio , un esempio di metilosi
I monosaccaridi si trovano in natura libera, ma anche in forma legata come carboidrati, come il contenuto di zucchero di un glicoside e come esteri di acidi inorganici come acido fosforico o acido monosolforico.
Essi sono costruite in piante da anidride carbonica e acqua nel ciclo Calvino il processo di fotosintesi . In caso di insufficiente apporto di carboidrati, gli animali e l'uomo devono ricorrere agli amminoacidi per sintetizzare da essi i monosaccaridi. Tuttavia, questo processo è associato a un maggiore dispendio di energia. I vari monosaccaridi possono essere convertiti l'uno nell'altro da tutti gli organismi, cosicché, a differenza degli acidi grassi e degli amminoacidi, non si conoscono zuccheri essenziali.
Ciclitoli
I ciclitoli sono strettamente correlati ai monosaccaridi. Si intende che questo significhi cicloalcani con almeno tre gruppi idrossilici. I rappresentanti più comuni qui sono gli esaidrossicicloesani, che sono anche chiamati inositi . Sono disponibili in forma libera o fosforilati . Più recentemente, è stato rilevato il loro ruolo di secondo messenger ( secondo messenger ) . La sostituzione di uno o più gruppi idrossilici con un gruppo amminico dà amminodeossinositi.
Di- e oligosaccaridi
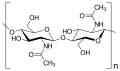
Gli oligosaccaridi sono costituiti da due o più unità di zucchero e vengono di conseguenza indicati come di-, tri-, tetrasaccaridi, ecc. Il disaccaride di gran lunga più comune è il saccarosio (zucchero di canna o di barbabietola), che consiste in un'unità di glucosio e fruttosio.
Il saccarosio si trova in molte piante. Si ottiene industrialmente da forme coltivate di canna da zucchero ( Saccharum officinarum , contenuto 14-20%) e barbabietola da zucchero ( Beta vulgaris , contenuto 16-20%).
Un altro disaccaride molto importante è il lattosio , che è praticamente l'unica fonte di carboidrati nella dieta dei neonati di mammiferi (Mammalia). Il lattosio è costituito da galattosio 1,4-legato con glucosio . Altri importanti rappresentanti dei disaccaridi sono il trealosio (insetti, funghi, lievito, alghe, batteri e muschio), la gentiobiosi (ad es. Come residuo zuccherino dell'amigdalina - il glicoside della mandorla amara ( Prunus amygdalus amara )) e la primaverina (dalle primule ( Primula )).
Polisaccaridi
I polisaccaridi sono sostanze naturali onnipresenti. Un polisaccaride importante è l' amido , una sostanza di riserva vegetale di grande importanza per l'alimentazione umana e animale. I polisaccaridi servono come materiale di riserva o formano la struttura di cellule o organismi. Costituiscono anche la base per le pareti cellulari che circondano le cellule di batteri e piante. Come componente della parete cellulare delle piante, la cellulosa è di eccezionale importanza, che svolge anche un ruolo importante nella nutrizione dei ruminanti . Altri importanti polisaccaridi che fungono da elementi costitutivi della parete cellulare nelle piante sono le pectine e l' emicellulosa . Contenente polisaccaridi che gli aminosugar vengono utilizzati negli animali e nei funghi sotto forma di chitina , che è un omopolisaccaride della N- acetil glucosamina .
Un certo numero di polisaccaridi hanno un'importanza nativa o modificata chimicamente come additivi nell'industria alimentare, farmaceutica, tessile e cosmetica. Sono ottenuti da materiale vegetale o biotecnologicamente . Questi includono xanthan , dextran , levan e pullulan .
Glicosidi
I glicosidi sono coniugati di mono- o oligosaccaridi con alcoli, tioli , aldeidi o ammidi , che sono collegati direttamente tramite l' atomo di carbonio anomerico o tramite un eteroatomo. Sono anche noti glicosidi C in cui vi è un legame carbonio-carbonio puro perché il gruppo idrossile anomerico è stato rimosso prima del legame. A seconda del tipo di legame, si parla di glicosidi O , S , N o C.
A rigor di termini, anche gli oligo e i polisaccaridi sono glicosidi, ma il termine glicoside viene solitamente utilizzato solo per i coniugati con residui non carboidrati. Questo residuo è noto come aglycon. È stata trovata una varietà di composti per l'aglicone. Solo alcuni importanti rappresentanti sono elencati qui come esempi.
| Gruppo funzionale dell'aglicone legato allo zucchero | Cognome | struttura | Evento |
|---|---|---|---|
| fenolo | Arbutin | 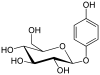 |
L'arbutina è un semplice glicoside e si trova in un'ampia varietà di frutti. L'aglicone qui è un idrochinone e il residuo zuccherino è un β-glucosio. |
| alcol | Oleandrin | 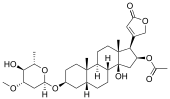 |
Oleandrin è un ingrediente dell'oleandro ( Nerium oleander ) e ha uno steroide come aglicone |
| alcol | Digitossina |  |
La digitossina è un ingrediente del ditale rosso ( Digitalis purpurea ) e ha uno steroide come aglicone |
| Tiocarbossammide | Sinigrin | 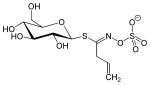 |
La sinigrina è un ingrediente di senape nera ( Brassica nigra ) e rafano ( Armoracia rusticana ) e ha un allile tiocarbossammide come aglicone |
| Aldeide (cianoidrina) | Amigdalina |  |
L'amigdalina è il glicoside cianogeno della mandorla amara ( Prunus amygdalus amara ) e trasporta la cianoidrina della benzaldeide come aglicone |
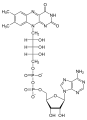
| Eterociclo dell'azoto | Adenosina |  |
L'adenosina è un elemento costitutivo del DNA e ha una base purinica come aglicone |
| Antrachinone | Barbaloin |  |
La barbaloina si trova in vari tipi di aloe ( aloe ) e ha un derivato antrachinonico come aglicone |
I glicosidi sono utilizzati principalmente in ambito farmaceutico come glicosidi cardiaci (digitossina) o come antibiotici ( eritromicina ) e sono ottenuti da fonti naturali. Dal punto di vista biologico, sono di importanza indispensabile come elementi costitutivi del DNA e dell'RNA.
La formazione di glicosidi negli organismi spesso serve a portare un aglicone piuttosto apolare in una forma idrosolubile.
Peptidoglicani
I peptidoglicani, chiamati anche mureina, sono coniugati di polisaccaridi con peptidi. Danno alle pareti cellulari dei batteri la loro forza. Sono costituiti da un disaccaride ( N -acetilglucosamina β- (1,4) -collegato con acido N- acetilmuramico ), che forma un polisaccaride ed è reticolato tramite brevi catene peptidiche. La reticolazione è formata da una transpeptidasi , che può essere inibita dagli antibiotici e quindi prevenire la formazione di membrane cellulari stabili.
Lipidi
Lipidi è un termine collettivo per composti non polari che possono essere estratti da materiale organico con solventi organici non polari come etere , etere di petrolio o cloroformio . Questo termine è puramente storico, poiché estrae composti che non hanno somiglianze strutturali tra loro (come terpeni o steroidi ), mentre altri sono strutturalmente simili ai grassi, come i glicolipidi .
Oggi i lipidi sono composti derivati dai grassi , cioè esteri di acidi grassi con alcoli monoidrici o poliidrici.
Acidi grassi

Gli acidi grassi naturali più comuni sono gli acidi carbossilici a catena lunga con un numero pari di atomi di carbonio. Si distingue tra acidi grassi saturi e insaturi, cioè con o senza (uno o più) doppi legami nella catena alchilica. I doppi legami degli acidi grassi naturali sono sempre configurati in Z ( configurazione cis ).
Alcuni degli acidi grassi insaturi sono essenziali per l'uomo perché non possono essere sintetizzati dall'organismo e devono quindi essere ingeriti con il cibo. Sono in parte come vitamina F , rispettivamente.
In natura, gli acidi grassi sono raramente liberi, ma di solito sono legati agli alcoli tramite un legame estere. Il componente alcolico più comune è la glicerina (glicerolipidi). Sono anche noti esteri con amminoalcoli (sfingolipidi), monosaccaridi (glicolipidi), dioli (lipidi diolici) e mioinositolo .
Gli acidi carbossilici alifatici ramificati ea catena più lunga, a causa della loro biosintesi completamente diversa, non sono classificati come acidi grassi ma come terpeni .
Eicosanoidi
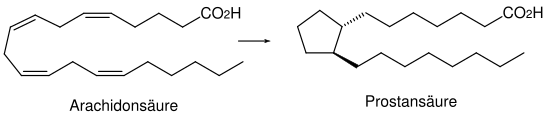
Gli acidi grassi insaturi costituiscono i composti di partenza per un gran numero di sostanze regolatrici. La base per questo è l' acido arachidonico , che è un acido grasso insaturo e contiene venti atomi di carbonio. Da qui deriva il nome eicosanoidi . L'acido arachidonico si forma nell'organismo dall'acido linoleico essenziale attraverso l'estensione della catena e la disidratazione.
La struttura delle prostaglandine , che sono gli eicosanoidi più importanti, è derivata dall'acido prostanoico . Sono sempre costituiti da un anello a cinque membri con due catene laterali adiacenti. Sia le catene laterali che l'anello a cinque membri possono portare diversi gruppi funzionali.
I composti analoghi con un anello a sei membri sono chiamati trombossani .
Grassi

I grassi sono gli esteri degli acidi grassi con glicerina. Questi sono principalmente trigliceridi, perché i mono- e digliceridi svolgono un ruolo solo come intermedi metabolici e raramente sono liberi. Poiché la glicerina è un alcool triidrato, ci sono anche esteri misti oltre agli esteri di tre molecole dello stesso acido grasso. Se questo conferisce al residuo di glicerolo un centro di asimmetria, i grassi sono composti chirali e otticamente attivi attraverso la biosintesi tramite L -glicerolo-3-fosfato (G3P).
I grassi si trovano in tutti gli animali come riserve di energia in tessuti specializzati; il tessuto adiposo può contenere fino all'80% di grasso. I semi di varie piante immagazzinano anche i grassi.
Di solito non è possibile separare grassi diversi, in quanto si tratta di miscele multiple di sostanze con proprietà chimiche e fisiche molto simili.
Cere
Le cere sono esteri non polari di acidi grassi e alcoli alifatici ciclici oa catena lunga. Le cere presenti in natura sono generalmente difficili da separare miscele di sostanze, che sono più di importanza tecnica. Le cere di solito servono come agenti strutturanti, come nei favi, e nella maggior parte dei casi probabilmente non possono più essere immesse nel metabolismo. Le eccezioni sono alcuni animali marini che producono cera come materiali di riserva, come B. ratto balena ( cetaceo ). Nelle piante, le cere formano la cuticola come protezione contro l'evaporazione. Il radicale alchilico del gruppo alcolico può essere ramificato o non ramificato. Nei mammiferi, il gruppo alcolico consiste principalmente nel colesterolo .
Lipidi complessi
Come lipidi complessi o lipidi che formano la membrana , vengono chiamati tali lipidi, che sono coinvolti nella sintesi delle membrane cellulari. Oltre ai residui di acidi grassi non polari, questi lipidi hanno gruppi polari. Questi gruppi polari danno loro la capacità di auto-organizzarsi in mezzi acquosi. Ciò può essere dimostrato in condizioni di laboratorio dalla formazione di liposomi . Una struttura simile può essere trovata nelle membrane cellulari. Nei mezzi acquosi, i gruppi polari si organizzano nella direzione dell'acqua polare ei gruppi non polari formano un doppio strato lipidico - con l'acqua all'esterno e all'interno del doppio strato lipidico.

Fosfolipidi , sfingolipidi e glicolipidi sono lipidi che formano la membrana cellulare. Differiscono nei loro residui polari. Nel caso dei fosfolipidi, è un estere dell'acido fosforico del digliceride. Ci sono ancora residui polari sul residuo fosfato, come la colina ( lecitina ) o l' etanolammina ( cefalina ). A differenza dei fosfolipidi, gli sfingolipidi derivano dalla sfingosina . L'acido grasso è legato alla sfingosina tramite un legame ammidico, che a sua volta è collegato a un gruppo polare come la serina , l'etanolammina o la colina tramite un residuo di fosfato tramite legami esterei . I glicolipidi, invece, sono diversi derivati di acidi grassi con un gruppo zuccherino come residuo polare, che possono essere sia del tipo gliceride, del tipo sfingolipidico, sia esteri di acidi grassi semplici dei monosaccaridi.
Composti isoprenoidi
I composti isoprenoidi derivano dall'isoprene e sono formalmente oligomeri o polimeri dell'isoprene. Questo principio è stato riconosciuto dal vincitore del Premio Nobel Leopold Ružička . Da questo si forma il gruppo di sostanze naturali chiamate terpeni e steroidi. Questi ultimi sono anche terpeni nel vero senso della parola, ma sono considerati separatamente a causa della loro speciale importanza biologica. Ciò che tutti i terpeni hanno in comune è che sono costituiti dall'acido mevalonico e attraverso la via dell'acido mevalonico con lo stesso nome .
Terpeni
Il gruppo di sostanze terpeniche ha un'enorme varietà di strutture di carbonio. Ciò che hanno tutti in comune, tuttavia, è che derivano dall'isoprene e rappresentano i multipli di questa molecola. Uno differenzia i terpeni in base al numero dei loro atomi di carbonio. Praticamente tutte le strutture terpeniche hanno nomi comuni e prendono il nome dalla loro fonte biologica. I gruppi funzionali vengono spesso aggiunti come prefisso o suffisso al nome della struttura in carbonio.
| Cognome | Numero di atomi di carbonio | Numero di unità di isoprene | Esempi |
|---|---|---|---|
| Isoprene | 5 | 1 | Isoprene |
| Monoterpeni | 10 | 2 | Mentolo , carvone , thujanon , canfora |
| Sesquiterpeni | 15 ° | 3 | Farnesol , sesquisabines , cadalenol , artemisites |
| Diterpeni | 20th | 4 ° | Retinal (vitamina A), Paclitaxel , Rosan , Nimbion , Gibberellan |
| Sesterterpeni | 25th | 5 | Neomanoalid , Scalarin , Hyrial |
| Triterpeni | 30th | 6 ° | Squalene , protostano , lanosterolo , oleanano |
| Tetraterpeni | 40 | 8 ° | Caroteni (provitamina A), xantofille |
| Polyterpeni | > 40 | > 8 | Gomma naturale , guttaperca |
I monoterpeni includono anche gli iridoidi , che sono caratterizzati dall'iridodial del corpo di base .
I sesterterpeni rappresentano un gruppo quantitativamente piccolo di terpeni.Se gli atomi di carbonio vengono rimossi durante il metabolismo, ai composti viene assegnato il prefisso Nor, come il sesquiterpene norpatchoulenol , in cui una molecola di metano è stata formalmente rimossa dall'alcool patchouli originale .
I terpeni svolgono una moltitudine di funzioni biologiche, che vanno dagli aromi e fragranze ai feromoni alle funzioni vitaminiche (vitamina A) e ai precursori degli ormoni (ormoni steroidei). Le loro applicazioni tecniche vanno dai prodotti farmaceutici ( taxol ) o steroidi agli insetticidi ( piretroidi ) e alle sostanze odorose per l'industria cosmetica.
Steroidi
Gli steroidi sono sostanze naturali diffuse nel mondo animale e vegetale. Sono tutti derivati dallo squalene triterpenico , che ciclizza per formare la struttura dello sterano tetraciclico. Negli steroidi naturali, gli anelli B e C e gli anelli C e D sono entrambi trans collegati e sono chiamati gonani . Gli anelli A e B del gonano possono essere collegati sia cis - (5β-gonan) che trans - (5α-gonan). Nel caso degli steroidi naturali, questi sono sempre collegati cis , cioè 5β-gonani. Lo steroide più importante negli esseri umani e negli animali è il colesterolo , che non si trova nelle piante. Le lipoproteine e gli ormoni steroidei sono costituiti dal colesterolo , proprio come gli ormoni della corteccia surrenale ( corticosteroidi ). Gli ormoni sessuali dei mammiferi, compreso l'uomo, sono steroidi.
Idrochinoni poliprenilici
La vitamina K umana così come molte altre sostanze simili in tutti gli esseri viventi hanno la caratteristica comune di un residuo di idrochinone e di un residuo poliprenilico attaccato. Gli esempi più noti e le loro abbreviazioni sono ubichinoni (nell'uomo ubichinone-10 , coenzima Q-10), fillochinone (vitamina K), menadione , menachinone (MK), plastochinone (PQ) e tocochinone . Per il rilevamento affidabile di queste sostanze , come ad esempio, sono necessari preparazioni di campioni relativamente complesse e metodi analitici B. Tocochinone. Agiscono come trasportatori di elettroni nella catena respiratoria mitocondriale e batterica .
Composti aromatici
Negli organismi ci sono fondamentalmente tre percorsi biosintetici che portano a composti aromatici: il percorso shikimato , il percorso malonato e il percorso mevalonato .
Il percorso shikimato si basa sul metabolismo dei carboidrati e attraversa l' acido shikimico fino alle sostanze aromatiche naturali. Questo percorso si svolge principalmente nelle piante superiori. Queste sostanze naturali sono spesso caratterizzate da aromatici fenolici altamente ossidati con una catena laterale lineare con gruppi funzionali. I gruppi fenolici si trovano principalmente nelle posizioni 3, 4 e 5 della catena laterale.
La via del malonato (via del polichetide) si basa sul metabolismo degli acidi grassi. La giustapposizione di unità di acetato crea un composto policarbonile che può ciclizzare in una o più condensazioni aldoliche per formare aromatici mononucleari o polinucleari. Questi composti sono caratterizzati da aromatici altamente ossidati, che spesso contengono anche chinoni o idrochinoni , ma senza catene laterali più lunghe. I gruppi dell'ossigeno sono quindi nella posizione 1,4. La via del malonato si trova principalmente nei microrganismi.

Il Mevalonatweg porta anche a sostanze naturali aromatiche, i terpeni. Un esempio è la biosintesi del timolo . Gli aromatici prodotti in questo modo spesso portano i gruppi isopropilici caratteristici dei terpeni .
Gli organismi animali raramente producono essi stessi composti aromatici. Si tratta quindi di solito di componenti alimentari essenziali (aminoacidi aromatici e vitamine).
Derivati del fenilpropano
I derivati del fenilpropano sono composti aromatici con una catena laterale propilica. L'aromatico spesso trasporta gruppi idrossilici o metossi. La catena laterale del propile può essere satura o insatura, formare un ciclo o trasportare vari gruppi funzionali. Questa classe di composti si forma nelle piante e nei microrganismi attraverso la via biosintetica dello shikimate . Insieme ai terpeni, i fenilpropanoidi sono il secondo costituente più comune degli oli essenziali. I fenilpropani ben noti sono la cinnamaldeide , l' anetolo e l' estragolo . Come materiale da costruzione per il legno, le lignine sono un polimero dei derivati del fenilpropano.
Flavonoidi
I flavonoidi appartengono ai pigmenti vegetali e sono strutturalmente derivati dai fenilpropanoidi. Pertanto, si trovano spesso fenoli o metossifenoli qui . Sono spesso glicosidicamente legati ai carboidrati e formano l'aglicone. A seconda del gruppo funzionale sull'anello eterociclico, si distingue tra flavan, flavone, flavonolo, flavonone e flavonololo. I flavonoidi sono principalmente importanti come pigmenti vegetali e formano la maggior parte di tutti i pigmenti dei fiori.
Tannini
Il termine generico di agenti concianti si riferisce a composti inorganici e organici in grado di convertire le pelli animali in pelle . Gli agenti concianti organici hanno in comune il fatto di contenere gruppi fenolici , ma non formano una classe uniforme di sostanze. L'agente conciante più importante e conosciuto, che è una delle sostanze naturali, è il tannino ed è un poliidrossifenolo. Gli agenti concianti comprendono anche alcuni flavoni fenolici e i loro prodotti di condensazione dimerica. Questi, come i flavoni stessi, sono spesso sotto forma di agliconi di glicosidi.
Polyketides
I polichetidi sono un gruppo ampio e molto eterogeneo di prodotti naturali. Comprende composti alifatici , ciclici , aciclici e aromatici . Le loro funzioni biologiche sono spesso sconosciute. Hanno differenze strutturali molto grandi, ma appartengono tutti alla stessa classe di prodotti naturali. I polichetidi sono caratterizzati da una via biosintetica comune. Quello che hanno tutti in comune è che contengono una spina dorsale di carbonio composta da acido acetico e acido propionico. Come per i terpeni, si distingue tra i polichetidi in base al numero di unità di acetato.
| Cognome | Numero di acetati | Esempi |
|---|---|---|
| Triketide | 3 |

|
| Tetraketides | 4 ° |
|
| Pentaketide | 5 |
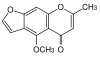
|
| Heptaketide | 7 ° |

|
| Alcaloidi polichetidici | Incorporazione di ammoniaca |

|
| Antrachinoni | 8 ° |
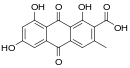
|
| Tetracicline | 8 unità di malonato |

|
Gli acidi polichetocarbossilici costituiscono il punto di partenza di tutti i chetidi. Fondamentalmente, troviamo le reazioni nella biosintesi dei polichetidi Claisen Esterkondensation , la condensazione aldolica e la condensazione di Dieckmann .
Le seguenti reazioni sono note come reazioni aldoliche , formazione di esteri o eteri enolici , metilazioni, clorinazioni o idrossilazioni, ma anche riduzioni dei gruppi carbossilici o carbonilici ad alcoli o gruppi metilenici. Si osserva anche la decarbossilazione del gruppo β-chetoacido.
Eterocicli
Pteridine
Le pteridine derivano dalla struttura di base della pteridina , ad esempio le vitamine riboflavina (vitamina B 2 ) e acido folico , i coenzimi FAD e FMN e i cofattori del molibdeno , tutti derivati dalla molibdopterina . Le loro funzioni come cofattori sono diverse.
Derivati della piridina
In particolare rientrano in questa classe di sostanze l'acido nicotinico (vitamina B 3 ) e il piridossal fosfato con i suoi precursori piridossina , piridossale e piridossamina (vitamina B 6 ).
Nucleosidi
Poiché i nucleosidi sono N- glicosidi di sistemi designati eterociclici . In un senso più stretto, in particolare gli elementi costitutivi del DNA e dell'RNA sono chiamati acidi nucleici. Con questi acidi nucleici, il residuo zuccherino è sempre un ribosio (RNA) o desossiribosio (DNA). Nel DNA stanno usando deossiribonucleico le informazioni genetiche immagazzinate. Con l'aiuto degli acidi ribonucleici, l' RNA può catalizzare le reazioni biochimiche e servire come trasmettitore di segnali o archivio di informazioni.
Sono noti nucleosidi naturali con basi puriniche ( adenina , guanina ) e con basi pirimidiniche ( citosina , timina e uracile ).
| Purine | Pirimidine | ||
|---|---|---|---|
 Adenina (A) |
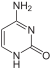 Citosina (C) |
||
 Guanina (G) |
|
||
| Formule strutturali delle basi azotate nel DNA (A, G, C, T) e RNA (A, G, C, U). Il legame N - glicosidico al ribosio o al desossiribosio nel DNA si verifica in ogni caso nel gruppo NH che punta verso il basso nelle figure. | |||
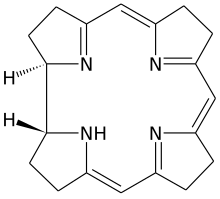
Porfirine e corrinoidi
I prodotti naturali primari includono anche una serie di altre classi di composti, come i tetrapirroli , che sono formati da quattro residui pirrolici legati da un ponte metinico . I tetrapirroli, le porfirine e i clori a forma di anello sono di grande importanza qui . Le forfirine costituiscono la base della clorofilla , del citocromo e dell'emoglobina e sono il complesso legante di un atomo di ferro (II). Nelle clorofille, i cloro sono il complesso legante del magnesio (II) come atomo centrale. Hanno una varietà di compiti nell'organismo, che vanno dal trasporto e immagazzinamento dell'ossigeno (emoglobina e mioglobina ) al trasferimento di elettroni ed energia alla catalisi delle reazioni biochimiche (vitamina B 12 e citocromo P 450) come coenzima .
Alcaloidi
Già nel 1806 la morfina fu il primo alcaloide ad essere isolato dal farmacista tedesco Friedrich Sertürner . Il termine alcaloidi fu coniato nel 1819 da Carl Friedrich Wilhelm Meißner , che lo interpretò come tutte le sostanze naturali di base. Il termine è stato successivamente esteso ad altre sostanze naturali contenenti azoto. Oggi tutte le sostanze naturali contenenti azoto sono riassunte sotto questo nome, anche se non esiste ancora una definizione uniforme. Gli alcaloidi hanno spesso effetti biologici e costituiscono una base importante come strutture di piombo per ingredienti farmaceutici attivi.
Esistono vari nomi per le classi di alcaloidi che non vengono utilizzati in modo uniforme in letteratura. Da un lato, gli alcaloidi sono denominati in base alla loro origine botanica - Solanum -, Papaver -, Angostura -, Lobelia alcaloidi, ecc. - ma dall'altro sono anche suddivisi in piridina, chinolina o alcaloidi steroidei dal loro composto chimico originario .
Spesso solo i composti sono indicati come alcaloidi che derivano dagli amminoacidi proteinogenici e contengono eterocicli azotati aromatici. Secondo questa definizione, tuttavia, varie sostanze naturali contenenti azoto come coniina , piperina e caffeina non sono alcaloidi.
Anche la classificazione sistematica degli alcaloidi non è uniforme. Da un lato v'è la classificazione in base alla loro struttura chimica, cioè in funzione del tipo di eterociclo azotato: Risultano quindi, per esempio, di steroidi , indolo , piridina o tropano alcaloidi. Anche la classificazione in base all'origine è comune: alcaloidi dell'ergot , curaro o oppiacei .
Nella letteratura chimica odierna, gli alcaloidi sono raggruppati nei seguenti gruppi, classificati in base alla loro struttura chimica:
- Alcaloidi con scheletro di piperidina , pirrolo , pirrolidina e piridina
- Alcaloidi con isochinolina , chinolina , chinazolina e scheletro di indolo
- Alcaloidi con indolizine , pirrolizidina e chinolizidinici ponteggi
- Alcaloidi purinici
- Alcaloidi steroidei
Amine biogene
Le ammine biogene sono composti che si formano semplicemente decarbossilando un amminoacido e svolgono un ruolo come componente importante dei lipidi, come coenzima o come neurotrasmettitore ( acetilcolina , triptamina , serotonina o istamina ). In termini farmaceutici, la L - dopa come farmaco per il Parkinson gioca un ruolo importante qui. Altri noti rappresentanti sono l' adrenalina , l' efedrina e la mescalina .
Guarda anche
letteratura
- Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs, W. Ternes: Naturstoffchemie , 3 °, completamente rivisto. e exp. Edizione, Springer Verlag 2008, ISBN 978-3-540-73732-2 .
- Peter Nuhn : Chimica dei prodotti naturali. Prodotti naturali microbici, vegetali e animali , 4a edizione, S. Hirzel Verlag, Stoccarda 2006, ISBN 978-3-7776-1363-5 .
link internet
Prove individuali
- ↑ Peter Nuhn : Chimica dei prodotti naturali. Prodotti naturali microbici, vegetali e animali , 2a edizione, S. Hirzel Verlag, Stoccarda 1990, pagg. 20-23; ISBN 3-7776-0473-9 .
- ^ Otto Krätz: 7000 anni di chimica , Nikol Verlagsgesellschaft, Amburgo 1999; ISBN 3-933203-20-1 .
- ↑ Spiegazione dei termini e delle abbreviazioni. In: REACH Helpdesk. 24 giugno 2013. Estratto il 29 luglio 2019 .
- ↑ a b Regolamento (CE) n. 1907/2006 sulla registrazione, valutazione, autorizzazione e restrizione delle sostanze chimiche (REACH) nella versione consolidata del 2 luglio 2019
- ↑ BMAS - Leggi: Ordinanza sugli agenti biologici ( Cimelio del 15 agosto 2014 in Internet Archive )
- ↑ A. Fleming: Sull'azione antibatterica delle colture di un penicillium, con particolare riferimento al loro utilizzo nell'isolamento di B. influenzae. 1929. In: Bull. World Health Organ . Volume 79, Number 8, 2001, pp. 780-790, PMID 11545337 . PMC 2566493 (testo completo gratuito).
- ↑ Mansukhlal C. Wani, Harold Lawrence Taylor, Monroe E. Wall, Philip Coggon, Andrew T. McPhail: agenti antitumorali vegetali. VI. Isolamento e struttura del taxolo, un nuovo agente antileucemico e antitumorale di Taxus brevifolia , in: J. Am. Chem. Soc. , 1971, 93 , pagg. 2325-2327; doi: 10.1021 / ja00738a045 .
- ↑ Gerhard Höfle, Norbert Bedorf, Heinrich Steinmetz, Dietmar Schomburg, Klaus Gerth, Hans Reichenbach: Epothilon A e B - nuovi macrolidi a 16 membri con effetti citotossici: isolamento, struttura nel cristallo e conformazione in soluzione , in: Angewandte Chemie , 1996, 108 , pp. 1671-1673; doi: 10.1002 / anie.19961081342 .
- ↑ Nuova introduzione di zidovudina. In: Zeitschrift für Chemotherapie, 1987, numero 4. Estratto il 4 agosto 2013 .
- ↑ Lee Jia, Yuqing Zhao: Current Evaluation of the Millennium Phytomedicine - Ginseng (I): Etymology, Pharmacognosy, Phytochemistry, Market and Regulations , in: Curr. Med. Chem. , 2009, 16 , pagg. 2475-2484; PMC 2752963 (testo completo gratuito).
- ↑ Lee Jia, Yuqing Zhao, Xing-Jie Liang: Current Evaluation of the Millennium Phytomedicine - Ginseng (II): Collected Chemical Entities, Modern Pharmacology, and Clinical Applications Emanated from Traditional Chinese Medicine , in: Curr. Med. Chem. , 2009, 16 , pagg. 2924-2942; PMC 2754208 (testo completo gratuito).
- ↑ Steven D. Ehrlich: Ginkgo Biloba Review. University of Maryland - Medical Center, 13 dicembre 2010, accesso 4 agosto 2013 .
- ↑ S. Ganguli: Neem: A therapy for all seasons ( Memento of June 5, 2011 in the Internet Archive ) (PDF; 21 kB), in: Current Science , 2002, 82 , p. 1304 (Archive.org).
- ↑ Bernd Schäfer: Sostanze naturali dell'industria chimica , spettro Akademischer Verlag, Heidelberg 2006; ISBN 978-3-8274-1614-8 .
- ^ Gareth Thomas: Medicinal Chemistry , seconda edizione, John Wiley & Sons Ltd, West Sussex, 2007, pagg. 90-110, 161-163; ISBN 978-0-470-02598-7 .
- ^ Rolf Breinbauer, Ingrid R. Vetter, Herbert Waldmann: Dai domini proteici ai farmaci candidati - prodotti naturali come strutture guida per la progettazione e la sintesi di librerie di sostanze , in: Angewandte Chemie , 2002, 114 , pp. 3002-3015; doi : 10.1002 / 1521-3757 (20020816) 114: 16 <3002 :: AID-ANGE3002> 3.0.CO; 2-V .
- ↑ Herbert Waldmann: Naturalmente combinatorio - sviluppo di farmaci guidato da sostanze naturali , in: Nachrichten aus der Chemie , 2003, 51 , pp. 126-131; doi: 10.1002 / nadc.20030510210 .
- ↑ Rudolf Hänsel , Otto Sticher (a cura di): Pharmakognosie - Phytopharmazie . 9a edizione. Springer Verlag, Heidelberg 2009, ISBN 978-3-642-00962-4 , p. 18-29 .
- ↑ W. Kreis: Principi del metabolismo secondario. (PDF) In: Fondamenti fitochimici. Miglioramenti del catalogo SWBplus presso il Baden-Württemberg Library Service Center , accesso il 5 agosto 2013 .
- ↑ Wolfgang Kraus, Michael Bokel, Adolf Klenk, Helmut Pöhn: The structure of azadirachtin and 22,23-dihydro-23β-methoxyazadirachtin , in: Tetrahedron Letters , 1985, 26 , pp. 6435-6438; doi: 10.1016 / S0040-4039 (00) 99020-8 .
- ↑ G. Büchi, RE Erickson, N. Wakabayashi: Terpenes. XVI.1,2 Costituzione di alcol patchouli e configurazione assoluta di Cedrene , in: J. Am. Chem. Soc. , 1961, 83 , pagg. 927-938; doi: 10.1021 / ja01465a042 .
- ↑ G. Büchi, William D. Macleod: Synthesis of Patchouli Alcohol , in: J. Am. Chem. Soc. , 1962, 84 , pagg. 3205-3206; doi: 10.1021 / ja00875a047 .
- ^ Gareth Thomas: Chimica medicinale, pp. 90-110.
- ↑ Peter Bützer: Articolo sulla vitamina B 12 . (PDF; 481 kB) (Non più disponibile online.) In: Molecular Dynamics - System Dynamics . Gennaio 2008, archiviato dall'originale il 6 dicembre 2012 ; Estratto il 4 agosto 2013 .
- ^ KC Nicolaou, EJ Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods , VCH Verlagsgesellschaft mbH, Weinheim, 1996, pp. 711-729; ISBN 3-527-29284-5 .
- ^ KC Nicolaou, EJ Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods , pp. 655-671.
- ^ Il premio Nobel per la chimica 1981. In: Nobelprize.org. Estratto il 4 agosto 2013 .
- ^ Il premio Nobel per la chimica 1965. In: Nobelprize.org. Estratto il 4 agosto 2013 .
- ^ KC Nicolaou, EJ Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods , pp. 99-134.
- ^ KC Nicolaou, SA Snyder: Classics in Total Synthesis II , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003; ISBN 978-3-527-30684-8 .
- ↑ Stefan Abrecht, Peter Harrington, Hans Iding, Martin Karpf, René Trussardi, Beat Wirz, Ulrich Zutter: The Synthetic Development of the Anti-Influenza Neuraminidase Inhibitor Oseltamivir Phosphate (Tamiflu ® ): A Challenge for Synthesis & Process Research , in: CHIMIA International Journal for Chemistry , 2004, 58 , pagg. 621-629.
- ↑ R. Carle: Phytochemicals - anticorpi e nutraceutici? In: vetline.de. 10 ottobre 2007, accesso 5 agosto 2013 . (PDF).
- ^ Bernhard Watzl, Claus Leitzmann: Sostanze bioattive negli alimenti , 3a edizione, Hippokrates Verlag GmbH Stuttgart, 2005, p. 15; ISBN 3-8304-5308-6 .
- ↑ Peter Nuhn: Naturstoffchemie , p. 23.
- ^ Hans Beyer , Wolfgang Walter : Textbook of organic chemistry , 21a edizione, S. Hirzel Verlag, Stoccarda 1988, pp. 822-828; ISBN 3-7776-0438-0 .
- ↑ Hans-Dieter Belitz , Walter Grosch: Textbook of food chemistry . 4a edizione. Springer Verlag, Heidelberg / Berlino 1992, ISBN 3-540-55449-1 , p. 9 .
- ↑ Peter Nuhn: Naturstoffchemie , p. 77.
- ↑ Peter Nuhn: Naturstoffchemie , pp. 159-160.
- ^ Gerhard Michal: Biochemical Pathway , Spectrum Akademische Verlagsgesellschaft, Heidelberg 1999, pagg. 37–40; ISBN 3-86025-239-9 .
- ↑ Beyer, Walter: Textbook of Organic Chemistry , p. 405.
- ↑ Peter Nuhn: Naturstoffchemie , pagg. 200–201.
- ↑ Peter Nuhn: Naturstoffchemie , p. 209.
- ↑ Peter Nuhn: Naturstoffchemie , pp. 174-181.
- ^ Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs, Naturstoffchemie , 2a edizione, Springer Verlag, 2002, p. 385; ISBN 3-540-43952-8 .
- ↑ Peter Nuhn: Naturstoffchemie , p. 297.
- ^ Nomenclatura dei glicolipidi. In: IUPAC . Estratto il 28 gennaio 2016 .
- ↑ Peter Nuhn: Naturstoffchemie , p. 397.
- ^ Roger RC New (a cura di), Liposomi un approccio pratico , IRL Press presso Oxford University Press, Oxford 1990, p. 13; ISBN 0-19-963077-1 .
- ↑ William H. Elliott, Daphne C. Elliott: Biochemistry and Molecular Biology , quarto ed., Oxford University Press, Oxford 2009, pp. 16-26; ISBN 978-0-19-922671-9 .
- ↑ Peter Nuhn: Naturstoffchemie , pp. 311–322.
- ↑ Leopold Ružička: Nobel Lecture: Multimembered Rings, Higher Terpene Compounds and Male Sex Hormones. In: Nobelprize.org. 12 dicembre 1945, accesso 6 agosto 2013 . (PDF; 525 kB)
- ↑ Katharina Munk: Studi di base in biologia: botanica . Casa editrice Spectrum Academic, Heidelberg 2001; ISBN 3-8274-0909-8 .
- ↑ Eberhard Breitmaier: Terpenes: Aromen, Düfte, Pharmaka , Pheromone , BG Teubner, Stuttgart 1999; ISBN 3-519-03548-0 .
- ↑ Beyer, Walter: Textbook of Organic Chemistry , pp. 678–679, 686–698.
- ↑ H.-U. Melchert, D.Pollok D, E. Pabel, K. Rubach, H.-J. Stan: Determinazione di tocoferoli, tocoferolchinoni e tocoferolidrochinoni mediante gascromatografia-spettrometria di massa e preseparazione con cromatografia su gel lipofila. : In J. Chromatogr. A. 8 novembre 2002; 976 (1-2): 215-20, PMID 12462612
- ↑ D. Pollok, H.-U. Melchert: Determinazione dell'alfa-tocoferolchinone in campioni di siero umano mediante cromatografia liquida con rilevamento della fluorescenza e derivatizzazione post-colonna in linea : In J. Chromatogr. A. 12 novembre 2004; 1056 (1-2): 257-62, PMID 15595560
- ^ Gerhard Michal: Biochemical Pathway , Spektrum Akademische Verlagsgesellschaft, Heidelberg, 1999, pagg. 59-60, 85-86 e 192; ISBN 3-86025-239-9 .
- ↑ Mikio Yamazaki, Taeko Usui, Shoji Shibata: The Biogenesis of Plant Products. II La biogenesi del timolo. ; in: Bollettino chimico e farmaceutico , 1963, 11 , pagg. 363-365; doi: 10.1248 / cpb.11.363 (testo completo).
- ↑ Peter Nuhn: Naturstoffchemie , p. 522.
- ↑ Peter von Sengbusch, Paul von Sengbusch: sostanze fenoliche. In: Il metabolismo secondario delle piante. Prodotti vegetali secondari (sostanze vegetali). Botany online 1996-2004 dell'Università di Amburgo , accesso 6 agosto 2013 .
- ↑ Otto Th. Schmidt, Walter Mayer: Tannini naturali , in: Angewandte Chemie , 1956, 68 (3), pp. 103-115; doi: 10.1002 / anie.19560680305 .
- ↑ Beyer, Walter: Textbook of Organic Chemistry , pp. 801–803, 882–883.
- ↑ Beyer, Walter: Textbook of Organic Chemistry , pp. 762, 768–769.
- ↑ Beyer, Walter: Textbook of Organic Chemistry , pp. 851–858.
- ↑ Beyer, Walter: Textbook of Organic Chemistry , pp. 710–717.
- ^ Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs: Naturstoffchemie , pp. 131–243.
- ↑ Peter Nuhn: Naturstoffchemie , pp. 553–597.