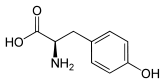
Tirosina
| Formula strutturale | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Struttura della L- tirosina, l'isomero presente in natura | ||||||||||||||||||||||
| Generale | ||||||||||||||||||||||
| Cognome | Tirosina | |||||||||||||||||||||
| altri nomi |
|
|||||||||||||||||||||
| Formula molecolare | C 9 H 11 NO 3 | |||||||||||||||||||||
| Breve descrizione |
aghi incolori, setosi e lucenti |
|||||||||||||||||||||
| Identificatori / database esterni | ||||||||||||||||||||||
| ||||||||||||||||||||||
| proprietà | ||||||||||||||||||||||
| Massa molare | 181,19 g mol −1 | |||||||||||||||||||||
| Stato fisico |
fermamente |
|||||||||||||||||||||
| densità |
1,46 g cm −3 (25 ° C) |
|||||||||||||||||||||
| Punto di fusione |
342–344 ° C (decomposizione) |
|||||||||||||||||||||
| pK s valore |
|
|||||||||||||||||||||
| solubilità |
|
|||||||||||||||||||||
| istruzioni di sicurezza | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Dati tossicologici | ||||||||||||||||||||||
| Per quanto possibile e consuetudine, vengono utilizzate le unità SI . Salvo diversa indicazione, i dati forniti si applicano a condizioni standard . | ||||||||||||||||||||||
La tirosina (abbreviata Tyr o Y ) nella sua forma L naturale è un α - amminoacido proteinogenico non essenziale che si trova nella maggior parte delle proteine . La tirosina è la sostanza di partenza per la biosintesi di DOPA , dopamina , catecolamine , melanina , tiroxina e tiramina . In molti animali, la biosintesi avviene dall'amminoacido essenziale fenilalanina ; la compromissione di questo percorso può innescare una varietà di difetti.
Isomeri
La tirosina ha uno stereocentro, quindi ci sono due enantiomeri . Se "tirosina" è menzionato in questo testo o nella letteratura scientifica senza alcun nome aggiuntivo ( prefisso ), si intende la L- tirosina presente in natura.
| Enantiomeri della tirosina | ||
| Cognome | L -irosina | D- tirosina |
| altri nomi | ( S ) - (-) - tirosina | ( R ) - (+) - tirosina |
| Formula strutturale |  |
|
| numero CAS | 60-18-4 | 556-02-5 |
| 556-03-6 (non specificato) | ||
| Numero CE | 200-460-4 | 209-112-6 |
| 209-113-1 (non specificato) | ||
| Scheda informativa ECHA | 100.000.419 | 100.008.285 |
| 100.008.286 (non specificata) | ||
| PubChem | 6057 | 71098 |
| 1153 (non spec.) | ||
| DrugBank | DB00135 | - |
| - (non specificato) | ||
| Numero FL | 17.022 | - |
| Wikidata | Q188017 | Q16082044 |
| Q27102882 (non specificata) | ||
Evento
La L- Tirosina fu caratterizzata per la prima volta da Justus von Liebig nel 1846 come componente proteico del formaggio ( antico greco τύρος týros , formaggio '), da cui deriva il nome. Si trova in grandi quantità nella caseina .
I seguenti esempi forniscono una panoramica del contenuto di tirosina e ciascuno si riferisce a 100 g di alimento; viene inoltre fornita la percentuale di tirosina nelle proteine totali:
| Cibo per 100 g | proteina | Tirosina | proporzione di |
|---|---|---|---|
| Maiale, crudo | 20,95 g | 797 mg | 3,8% |
| Filetto di petto di pollo, crudo | 21,23 g | 765 mg | 3,6% |
| Salmone, crudo | 20,42 g | 759 mg | 3,7% |
| Uovo di pollo | 12,56 g | 499 mg | 4,0% |
| Latte vaccino, 3,7% di grassi | 3,28 g | 158 mg | 4.8% |
| Semi di zucca | 30,23 g | 1093 mg | 3,6% |
| Noci | 15,23 g | 406 mg | 2,7% |
| Farina di frumento | 10,33 g | 312 mg | 3,0% |
| Farina di mais integrale | 6,93 g | 282 mg | 4.1% |
| Riso, non sbucciato | 7,94 g | 298 mg | 3,8% |
| Fagioli di soia, essiccati | 36,49 g | 1539 mg | 4,2% |
| Piselli secchi | 24,55 g | 711 mg | 2,9% |
Tutti questi alimenti contengono quasi esclusivamente L- tirosina legata chimicamente come componente proteico, ma non L- tirosina libera .
proprietà
Come monomero
A seconda del valore del pH , la tirosina può essere presente come "sale interno" o zwitterione . Il protone del gruppo carbossilico si attacca alla coppia di elettroni liberi dell'atomo di azoto del gruppo amminico :
Gli zwitterion non migrano nel campo elettrico perché sono scarichi verso l'esterno. Il punto isoelettrico è pH = 5,66 per la tirosina; a questo valore di pH ha la sua più bassa solubilità in acqua.
La L- tirosina isolata emette fluorescenza , come molti altri composti aromatici, se eccitata dalla luce UV .
- Volume di Van der Waals : 141
- Grado di idrofobicità : −1,3
Con un componente diazo adatto , la tirosina forma un colorante azoico rosso e può quindi essere rilevata qualitativamente utilizzando la reazione di Pauly .
Nelle proteine
La L- tirosina è un amminoacido proteinogenico . È richiesto come elemento costitutivo per la costruzione di numerose proteine durante la traduzione .
La L- tirosina è di particolare importanza nelle proteine coinvolte nei processi di trasduzione del segnale . Qui agisce come un destinatario di gruppi fosfato , che vengono trasferiti dalle proteine chinasi e modificano l' attività della proteina bersaglio, un recettore (vedi recettore tirosin chinasi ).
La L- tirosina svolge anche un ruolo importante nella fotosintesi riducendo la clorofilla ossidata come donatore di elettroni nel fotosistema II . Inizialmente perde il protone del suo gruppo OH fenolico , diventa un radicale neutro e viene quindi nuovamente ridotto dal gruppo di manganese quadricucleare nel fotosistema II .
metabolismo
biogenesi

Piante e maggior parte dei microrganismi tirosina sintetizzano nella via dell'acido shikimico con acido corismico . Dopo la ridistribuzione del corismato in prefenato, viene prodotto 4-idrossifenilpiruvato per mezzo di una prefenato deidrogenasi, dalla quale si forma la tirosina per transaminazione sotto l'azione di una transaminasi .
Nell'organismo animale, la tirosina è prodotta dalla 4- idrossilazione dipendente dalla biopterina sull'anello fenilico della L - fenilalanina . L' enzima che catalizza questa reazione è la fenilalanina idrossilasi ( EC 1.14.16.1 ), una monoossigenasi . È necessaria una molecola di ossigeno (O 2 ) e questa reazione crea una molecola d'acqua (H 2 O). Il precursore, l'amminoacido essenziale L- fenilalanina, viene assunto con il cibo.
La carenza di L- tirosina può verificarsi a causa della fenilchetonuria (PKU) . La L - fenilalanina ingerita attraverso il cibo non può essere correttamente idrossilata in posizione para , cosicché dalla fenilalanina non si può formare L- tirosina. In questo caso, il corpo L- tirosina deve essere nutrito per essere.

Precursore
La tirosina funge da materiale di partenza ( precursore ) per la biosintesi di varie altre sostanze.
- La formazione degli ormoni tiroidei L - triiodotironina (T 3 ) e L - tiroxina (T 4 ) nel colloide della tiroide si basa sulle subunità della tirosina.
- La decarbossilazione da parte dell'enzima aromatico L-amminoacido decarbossilasi (AADC) dà l' ammina biogenica tiramina .
- Un idrossilazione da parte dell'enzima tirosina idrossilasi - in melanociti spesso dell'enzima tirosinasi - porta a DOPA .
La DOPA, a sua volta, è un precursore di vari neurotrasmettitori e della melanina . Nel midollo surrenale , la decarbossilasi consente la produzione delle catecolamine adrenalina e noradrenalina , che vengono rilasciate nel sangue come sostanze messaggere. La produzione di dopamina dalla DOPA avviene nella membrana delle cellule nervose. La melanina della DOPA viene prodotta e rilasciata in particolare dai melanociti presenti nella pelle e nelle cellule del pigmento degli occhi , dove viene immagazzinata.
Fisiopatologia
In caso di stress nitrosativo , perossinitrito e tirosina vengono convertiti in nitrotirosina mediante sostituzione aromatica nucleofila . La nitrotirosina è utilizzata nella diagnostica di laboratorio come biomarcatore per stress nitrosativo o apoptosi (morte cellulare programmata).
Smantellamento
La degradazione della L -irosina ( para- idrossifenilalanina ) inizia con una transaminazione α-chetoglutarato- dipendente dalla L- tirosina transaminasi ( EC 2.6.1.5 ) a p- idrossifenil piruvato .

La fase successiva è catalizzata dalla 4-idrossifenilpiruvato diossigenasi ( EC 1.13.11.27 ) con l'incorporazione di ossigeno e la scissione di CO 2 per formare l' omogenato (2,5-diidrossifenil-1-acetato). Per dividere l' anello aromatico dell'omogenato, è necessaria un'altra diossigenasi, l' omogenato ossigenasi ( EC 1.13.11.5 ). L' acetoacetato di maleile è formato dall'incorporazione di un'altra molecola di O 2 .
Con i Maleylacetacetat- cis - trans - isomerasi ( EC 5.2.1.2 ) è formata in questo caso Fumarylacetat mediante rotazione della ossidazione risultante (dal gruppo idrossile) gruppo carbossilico . Questa isomerasi cis-trans contiene glutatione come coenzima . Il fumarilacetoacetato può infine essere scisso dalla fumarilacetoacetato idrolasi attraverso la ritenzione idrica.
Questo rilascia fumarato (anche un metabolita del ciclo citrato ) e acetoacetato (butano (3) un acido). L'acetoacetato è un corpo chetonico che viene attivato con succinil-CoA e può quindi essere convertito in due molecole di acetil-CoA (per il ciclo dell'acido citrico e la sintesi degli acidi grassi ).
Applicazioni
La tirosina è un precursore dei neurotrasmettitori , in particolare la dopamina e la norepinefrina . Aumentando l'assunzione di tirosina, la sua sintesi può essere temporaneamente aumentata in modo significativo, per circa mezz'ora. Tuttavia, questo ha solo un'influenza minore sull'umore. Il passaggio che determina la velocità di conversione nel metabolismo è catalizzato e limitato dalla tirosina idrossilasi , motivo per cui gli effetti sono inferiori rispetto all'aggiunta di L-DOPA . È noto da esperimenti su animali che la loro attività enzimatica diminuisce drasticamente a dosi elevate di tirosina a causa dell'inibizione in eccesso del substrato , così che il livello di dopamina diminuisce.
Alcuni studi hanno riscontrato un beneficio sotto stress , freddo o stanchezza. Non è stato possibile determinare un aumento delle prestazioni negli sport di resistenza (un'ora e mezza di ciclismo) attraverso l'assunzione di tirosina, ma attraverso l'assunzione di carboidrati.
L' apporto alimentare di L- tirosina serve come terapia sostitutiva o integrazione in caso di carenza, ad es. B. nella fenilchetonuria , altrimenti risulta una sottoproduzione di melanina ( albinismo ) e L - tiroxina ( cretinismo ). Inoltre, possono esserci problemi nella produzione di catecolamine .
Inoltre, L- tirosina è stato utilizzato per anni come adiuvante vettore depot in immunoterapia specifica sottocutanea (SCIT) grazie alle sue proprietà proteine adsorbente . Rispetto ad altri vettori di deposito come l'idrossido di alluminio o il fosfato di calcio , la L- tirosina è caratterizzata, tra le altre cose, dal vantaggio di essere completamente metabolizzabile e da un'emivita più breve di 48 ore nel sito di iniezione.
Produzione
L' idrolisi acida delle proteine contenenti cheratina si traduce in un idrolizzato proteico dopo la neutralizzazione, che consiste di circa 20 α-amminoacidi proteinogenici. Una frazione ricca di L - cistina e L- tirosina può essere ottenuta da questa semplicemente separando gli amminoacidi facilmente idrosolubili, poiché L- cistina e L- tirosina sono solo leggermente solubili in acqua. La L- tirosina si ottiene commercialmente utilizzando questo semplice metodo di separazione.
letteratura
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 5a edizione. Casa editrice Spectrum Academic, Heidelberg 2003, ISBN 3-8274-1303-6 .
link internet
Prove individuali
- ↑ a b c d Ingresso su l-tirosina. In: Römpp Online . Georg Thieme Verlag, consultato il 21 giugno 2014.
- ↑ a b Data sheet (S) - (-) - Tyrosine (PDF) da Merck , consultato il 13 marzo 2010.
- ^ A b F. A. Carey: Chimica organica. 5a edizione. The McGraw Companies, 2001, pagina 1059, Link
- ↑ a b Hans-Dieter Jakubke, Hans Jeschkeit: Aminoacidi, peptidi, proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2 , p. 40.
- ↑ una b voce sulla tirosina nella banca dati delle sostanze GESTIS del l' IFA , si accede il 23 Luglio 2016. (JavaScript richiesto)
- ^ L'iscrizione tirosina nel drugbank del l' Università di Alberta
- ↑ a b Hans-Dieter Jakubke, Hans Jeschkeit: Aminoacidi, peptidi, proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2 , p. 19.
- ↑ database dei nutrienti del Dipartimento dell'Agricoltura degli Stati Uniti , 23a edizione.
- ↑ Assegnazione studenti: CHEMKON 3/2018 . In: CHEMKON . nastro 25 , n. 3 , giugno 2018, p. 121–122 , doi : 10.1002 / ckon.201880371 .
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochemistry. 6a edizione. Spektrum Akademischer Verlag, Monaco 2007, ISBN 978-3-8274-1800-5 , pagg. 747f, 773ff.
- ↑ AW Abu-Qare, MB Abou-Donia: Biomarcatori dell'apoptosi: rilascio del citocromo c, attivazione della caspasi-3, induzione dell'8-idrossi-2'-deossiguanosina, aumento della 3-nitrotirosina e alterazione del gene p53. In: J Toxicol Env Salute Pt B Crit Rev . Volume 4, 2001, pagg. 313-332. PMID 11503418 .
- ↑ DD Rasmussen, B. Ishizuka, ME Quigley, SS Yen: Effetti dell'ingestione di tirosina e triptofano sulle concentrazioni plasmatiche di catecolamine e acido 3,4-diidrossifenilacetico . In: J. Clin. Endocrinol. Metab. nastro 57 , n. 4 , 1983, pagg. 760-763 , doi : 10.1210 / jcem-57-4-760 , PMID 6885965 .
- ↑ PD Leathwood, P. Pollet: cambiamenti dell'umore indotti dalla dieta nelle popolazioni normali . In: Journal of Psychiatric Research . nastro 17 , n. 2 , 1982, pagg. 147-154 , doi : 10.1016 / 0022-3956 (82) 90016-4 , PMID 6764931 .
- ↑ a b J. B. Deijen, JF Orlebeke: Effetto della tirosina sulla funzione cognitiva e sulla pressione sanguigna sotto stress . In: Brain Res. Bull. Band 33 , n. 3 , 1994, p. 319-323 , doi : 10.1016 / 0361-9230 (94) 90200-3 , PMID 8293316 .
- ^ HR Lieberman, S. Corkin, BJ Spring, RJ Wurtman, JH Growdon: Gli effetti dei precursori dei neurotrasmettitori alimentari sul comportamento umano . In: Am J Clin Nutr. nastro 42 , n. 2 , 1985, pag. 366-370 , PMID 4025206 .
- ↑ a b T. D. Chinevere, RD Sawyer, AR Creer, RK Conlee, AC Parcell: Effetti della L-tirosina e dell'ingestione di carboidrati sulle prestazioni degli esercizi di resistenza. In: Rivista di fisiologia applicata. Volume 93, numero 5, novembre 2002, pagg. 1590-1597, doi: 10.1152 / japplphysiol.00625.2001 . PMID 12381742 .
- ↑ HK Strüder, W. Hollmann, P. Platen, M. Donike, A. Gotzmann, K. Weber: Influenza della paroxetina, degli amminoacidi a catena ramificata e della tirosina sulle risposte del sistema neuroendocrino e sulla fatica negli esseri umani . In: Horm. Metab. Res. Band 30 , no. 4 , 1998, pagg. 188-194 , doi : 10.1055 / s-2007-978864 , PMID 9623632 .
- ^ JR Thomas, PA Lockwood, A. Singh, PA Deuster: la tirosina migliora la memoria di lavoro in un ambiente multitasking . In: Pharmacol. Biochimica. Behav. nastro 64 , n. 3 , 1999, p. 495-500 , doi : 10.1016 / S0091-3057 (99) 00094-5 , PMID 10548261 .
- ↑ Abdulla A.-B. Badawy, David L. Williams: Miglioramento della sintesi delle catecolamine nel cervello di ratto mediante somministrazione di piccole dosi di tirosina e prove per l'inibizione del substrato dell'attività della tirosina idrossilasi da parte di grandi dosi di amminoacido. In: Biochemical Journal. Volume 206, n. 1, luglio 1982, pp. 165-168; doi: 10.1042 / bj2060165 .
- ↑ Noelene S. Quinsey, Anh Q. Luong, Phillip W. Dickson: Analisi mutazionale dell'inibizione dei substrati nella tirosina idrossilasi. In: Journal of Neurochemistry. Volume 70, n. 5, novembre 1998, pagg. 2132-2138; doi: 10.1046 / j.1471-4159.1998.71052132.x .
- ^ A b S. Hao, Y. Avraham, O. Bonne, EM Berry: perdita di peso corporeo indotta dalla separazione, compromissione del comportamento di alternanza e tono autonomo: effetti della tirosina . In: Pharmacol. Biochimica. Behav. nastro 68 , n. 2 , 2001, pag. 273-281 , doi : 10.1016 / S0091-3057 (00) 00448-2 , PMID 11267632 .
- ^ RA Magill, WF Waters, GA Bray, J. Volaufova, SR Smith, HR Lieberman, N. McNevin, DH Ryan: Effetti di tirosina, fentermina, caffeina D-anfetamina e placebo sui deficit cognitivi e delle prestazioni motorie durante la privazione del sonno . In: Neuroscienze nutrizionali . nastro 6 , n. 4 , 2003, p. 237-246 , doi : 10.1080 / 1028415031000120552 , PMID 12887140 .
- ↑ DF Neri, D. Wiegmann, RR Stanny, SA Shappell, A. McCardie, DL McKay: Gli effetti della tirosina sulle prestazioni cognitive durante la veglia prolungata . In: Aviazione, spazio e medicina ambientale . nastro 66 , n. 4 , 1995, pag. 313-319 , PMID 7794222 .
- ↑ DK Reinstein, H. Lehnert, RJ Wurtman: La tirosina alimentare sopprime l'aumento del corticosterone plasmatico a seguito di stress acuto nei ratti . In: Life Sci. nastro 37 , n. 23 , 1985, pagg. 2157-2163 , doi : 10.1016 / 0024-3205 (85) 90566-1 , PMID 4068899 .
- ↑ JB Deijen, CJ Wientjes, HF Vullinghs, PA Cloin, JJ Langefeld: La tirosina migliora le prestazioni cognitive e riduce la pressione sanguigna nei cadetti dopo una settimana di un corso di addestramento al combattimento . In: Brain Res. Bull. Band 48 , n. 2 , 1999, pag. 203-209 , doi : 10.1016 / S0361-9230 (98) 00163-4 , PMID 10230711 .
- ^ CR Mahoney, J. Castellani, FM Kramer, A. Young, HR Lieberman: La supplementazione di tirosina mitiga i decrementi della memoria di lavoro durante l'esposizione al freddo . In: Fisiologia e comportamento . IN STAMPA, No. 4 , 2007, pagg. 575-582 , doi : 10.1016 / j.physbeh.2007.05.003 , PMID 17585971 .
- ↑ P. Baldrick, D. Richardson, AW Wheeler: Revisione della L-tirosina che conferma il suo uso umano sicuro come adiuvante. In: J. Appl. Toxicol. Volume 22, 2002, pagg. 333-344, doi: 10.1002 / jat.869 .
- ↑ Yoshiharu Izumi, Ichiro Chibata e Tamio Itoh: produzione e uso di amminoacidi. In: Angewandte Chemie . Volume 90, 1978, pagg. 187-194, doi: 10.1002 / anie.19780900307 .



