Isoleucina
| Formula strutturale | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
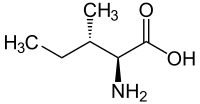
| ||||||||||||||||||||||
|
L -Isoleucina Per le strutture di altri isomeri, vedere stereoisomerismo | ||||||||||||||||||||||
| Generale | ||||||||||||||||||||||
| Cognome | Isoleucina | |||||||||||||||||||||
| altri nomi |
|
|||||||||||||||||||||
| Formula molecolare | C 6 H 13 NO 2 | |||||||||||||||||||||
| Breve descrizione |
solido incolore con un debole odore |
|||||||||||||||||||||
| Identificatori / database esterni | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Informazioni sui farmaci | ||||||||||||||||||||||
| Codice ATC | ||||||||||||||||||||||
| proprietà | ||||||||||||||||||||||
| Massa molare | 131,18 g mol −1 | |||||||||||||||||||||
| Stato fisico |
fermamente |
|||||||||||||||||||||
| Punto di fusione |
284 ° C (decomposizione, L -isoleucina) |
|||||||||||||||||||||
| pK s valore |
|
|||||||||||||||||||||
| solubilità |
solubile in acqua (40 g l −1 a 20 ° C, L -isoleucina) |
|||||||||||||||||||||
| istruzioni di sicurezza | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Per quanto possibile e consuetudine, vengono utilizzate le unità SI . Salvo diversa indicazione, i dati forniti si applicano a condizioni standard . | ||||||||||||||||||||||
L'isoleucina , abbreviata Ile o I , è nella sua forma L naturale un α - amminoacido proteinogenico essenziale .
Poiché l'isoleucina può essere derivata dall'acido aspartico , appartiene al gruppo dell'aspartato . Appartiene insieme ai suoi isomeri strutturali leucina , norleucina e tert -leucina per il gruppo di sostanze leucina .
storia
Nel 1901 Emil Fischer , che in seguito vinse il Premio Nobel , suggerì che la frazione di leucina da lui isolata conteneva, oltre alla leucina, un "amminoacido della stessa composizione ma con un maggior grado di rotazione". Infatti, nel 1903 il chimico tedesco Felix Ehrlich riuscì a isolare un composto isomerico alla leucina dalla melassa di zucchero di barbabietola , chiamato isoleucina. Felix Ehrlich ha riconosciuto la costituzione nel 1907 attraverso ulteriori indagini.
Evento
L'isoleucina è un componente legato ai peptidi delle proteine animali e vegetali . I seguenti esempi si riferiscono ciascuno a 100 g di alimento; viene inoltre fornita la percentuale di isoleucina nelle proteine totali.
| Cibo | proteina | Isoleucina | proporzione di |
|---|---|---|---|
| Manzo | 21,26 g | 967 mg | 4,5% |
| Filetto di petto di pollo | 23,09 g | 1219 mg | 5,3% |
| salmone | 20,42 g | 968 mg | 4.7% |
| Uovo di pollo | 12,58 g | 672 mg | 5,3% |
| Latte vaccino, 3,7% di grassi | 3,28 g | 198 mg | 6,0% |
| Noci | 15,23 g | 625 mg | 4.1% |
| Farina integrale | 13,70 g | 508 mg | 3,7% |
| Farina di mais integrale | 6,93 g | 248 mg | 3,6% |
| Riso, non sbucciato | 7,94 g | 336 mg | 4,2% |
| Piselli secchi | 24,55 g | 1014 mg | 4.1% |
Tutti questi alimenti contengono quasi esclusivamente L -isoleucina legata chimicamente come componente proteico, ma nessuna L -isoleucina libera allo stato grezzo .
Stereoisomeria
L'isoleucina ha due stereocentri, quindi ci sono quattro stereoisomeri ; Nel nostro ambiente, tuttavia, solo la L -isoleucina svolge un ruolo come amminoacido proteinogenico ed è fisiologicamente importante. Quando si parla di "isoleucina" senza alcun nome aggiuntivo ( descrittore ), si parla comunemente di L- isoleucina.
L'enantiomero della L -isoleucina naturale è la D -isoleucina. L - allo -isoleucina e il suo enantiomero D - allo -isoleucina sono diastereomeri della L -isoleucina.
| Isomeri di isoleucina | ||||
| Cognome | L -isoleucina | D -isoleucina | L - allo -isoleucina | D - allo -isoleucina |
| altri nomi | Acido (2 S , 3 S ) -2-ammino-3-metilpentanoico ( S ) -isoleucina |
Acido (2 R , 3 R ) -2-ammino-3-metilpentanoico (2 R , 3 R ) -2-ammino-3-metilvalerico |
Acido (2 S , 3 R ) -2-ammino-3-metilpentanoico | Acido (2 R , 3 S ) -2-ammino-3-metilpentanoico |
| Formula strutturale |

|

|

|
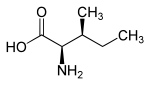
|
| numero CAS | 73-32-5 | 319-78-8 | 1509-34-8 | 1509-35-9 |
| 443-79-8 (non spec.) | ||||
| Numero CE | 200-798-2 | 206-269-2 | 216-142-3 | 216-143-9 |
| 207-139-8 (non specificato) | ||||
| Scheda informativa ECHA | 100.000.726 | 100.005.701 | 100.014.675 | 100.014.676 |
| 100.006.492 (non spec.) | ||||
| PubChem | 6306 | 76551 | 99288 | 94206 |
| 791 (non specifica) | ||||
| Wikidata | Q484940 | Q27103290 | Q27092902 | Q27109362 |
| Q27117434 (non specifica) | ||||
| Punto di fusione | Decomposizione: 284 ° C | |||
proprietà
L'isoleucina è presente nel punto isoelettrico (un certo valore di pH ) come zwitterione (sale interno), per cui il protone del gruppo carbossilico (-COOH) è dissociato e il gruppo amminico (-NH 2 ) è protonato.
- Catena laterale : lipofila
- punto isoelettrico : 5.94
- Volume di Van der Waals : 124
- Solubilità lipidica : LogP = 4.5
Importanza biochimica
Da un lato, l'isoleucina è necessaria come elemento costitutivo per la sintesi proteica . D'altra parte, può anche essere utilizzato per generare energia nelle cellule muscolari . Questo gioca un ruolo in una dieta ricca di proteine o durante uno sforzo più lungo e nelle fasi di fame in cui il corpo attinge alle proprie riserve. La scomposizione di isoleucina fornisce acetil-CoA e propionil-CoA .
Le stime del fabbisogno giornaliero per adulti sani variano, a seconda del metodo utilizzato, da 7,5 a 28 mg di isoleucina per chilogrammo di peso corporeo. Nell'organismo umano l'isoleucina si trova quasi esclusivamente in uno stato legato. La concentrazione di isoleucina libera nel sangue è di circa 7 mg / l; da 10 a 15 mg vengono escreti nelle urine al giorno.
Estrazione
I principali metodi di estrazione sono i processi di fermentazione in cui le soluzioni contenenti glucosio con l'aggiunta di L - treonina vengono convertite da microrganismi produttori di L -isoleucina. Per idrolisi delle proteine e successive operazioni di separazione degli idrolizzati si ottiene invece una miscela degli amminoacidi naturali L- leucina e L- isoleucina. Questi isomeri costituzionali possono quindi essere z. B. separati da un processo enzimatico.
uso
Come componente delle soluzioni per infusione di amminoacidi per la nutrizione parenterale, la L- Isoleucina, insieme ad altri amminoacidi, è ampiamente utilizzata nella medicina umana. Una “dieta chimicamente definita” somministrata per via orale contenente L- isoleucina è stata sviluppata per i pazienti con disturbi digestivi . In questa dieta, gli amminoacidi sono la fonte dell'azoto; tutti i nutrienti vitali sono in una forma chimicamente definita con precisione.
link internet
Prove individuali
- ↑ un b c d e f L'iscrizione L-isoleucina nella banca dati delle sostanze GESTIS del l' IFA , si accede il 5 Febbraio 2018. (JavaScript richiesto)
- ^ A b Hans Beyer, Wolfgang Walter: Textbook of Organic Chemistry . Hirzel Verlag, Stoccarda 1991, ISBN 3-7776-0485-2 , p. 823.
- ↑ S. Hansen: La scoperta degli amminoacidi proteinogenici dal 1805 a Parigi al 1935 nell'Illinois . ( Memento del l' originale dal 15 giugno 2016 in Internet Archive ) Info: Il dell'archivio collegamento è stato inserito automaticamente e non è stata ancora verificata. Controllare l'originale e il collegamento all'archivio secondo le istruzioni, quindi rimuovere questo avviso. (PDF) Berlino 2015.
- ↑ F. Ehrlich: Informazioni sull'isomero naturale della leucina . In: Ber Deutsche Chem Ges . Volume 37, 1904, pagg. 1809-1840, doi: 10.1002 / cber.19040370295 .
- ↑ F. Ehrlich: Informazioni sull'isomero naturale della leucina. Costituzione e sintesi di isoleucina . In: Ber Deutsche Chem Ges . Volume 40, No.2, 1907, pagg. 2538-2562, doi: 10.1002 / cber . 190704002181 .
- ↑ database dei nutrienti del Dipartimento dell'Agricoltura degli Stati Uniti , 21a edizione.
- ↑ Bernd Hoppe, Jürgen Martens: Aminoacidi - produzione ed estrazione . In: Chemistry in our time , 1984, 18, pp. 73-86.
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochemistry. 6a edizione. Casa editrice Spectrum Academic, Elsevier, Monaco 2007; Pp. 735, 746; ISBN 978-3-8274-1800-5 .
- ↑ AV Kurpad, MM Regan, T. Raj, JV Gnanou: requisiti di aminoacidi a catena ramificata in soggetti umani adulti sani . In: J. Nutr. , 2006, 136 (1 Suppl), pagg. 256S-263S, PMID 16365094 .
- ^ Roche Lexicon Medicine. 5a edizione. Urban & Fischer Verlag, Elsevier, Monaco di Baviera 2003, ISBN 978-3-437-15150-7 .
- ↑ a b Yoshiharu Izumi, Ichiro Chibata e Tamio Itoh: produzione e uso di amminoacidi . In: Angewandte Chemie , 1987, 90, pp. 187-194. Angewandte Chemie International Edition in English , 1978, 17, pp. 176-183, doi: 10.1002 / anie.197801761 .
- ↑ Hitoshi Enei, Kenzo Yokozeki, Kunihiko Akashi: recenti progressi nella produzione microbica di amminoacidi . Gordon & Breach Science Publishers, 1989, ISBN 978-2-88124-324-0 , p. 61.
- ↑ Jürgen Martens , Horst Weigel: Separazione enzimatica di L- Leucina e L- Isoleucina . In: Liebigs Annalen der Chemie , 1983, pagg. 2052-2054.
