valina
| Formula strutturale | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Immagine di L- valina, l'isomero naturale | ||||||||||||||||||||||
| Generale | ||||||||||||||||||||||
| Cognome | valina | |||||||||||||||||||||
| altri nomi |
|
|||||||||||||||||||||
| Formula molecolare | C 5 H 11 NO 2 | |||||||||||||||||||||
| Breve descrizione |
solido bianco con un debole odore |
|||||||||||||||||||||
| Identificatori esterni / banche dati | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Informazioni sui farmaci | ||||||||||||||||||||||
| Codice ATC | ||||||||||||||||||||||
| proprietà | ||||||||||||||||||||||
| Massa molare | 117,15 g · mol -1 | |||||||||||||||||||||
| Stato fisico |
fisso |
|||||||||||||||||||||
| densità |
1,23 g cm -3 |
|||||||||||||||||||||
| Punto di fusione |
295-300 °C |
|||||||||||||||||||||
| p K S valore |
|
|||||||||||||||||||||
| solubilità |
|
|||||||||||||||||||||
| istruzioni di sicurezza | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Per quanto possibile e consueto, vengono utilizzate unità SI . Salvo diversa indicazione, i dati forniti si applicano alle condizioni standard . | ||||||||||||||||||||||
La valina , abbreviata in Val o V , è nella sua forma L naturale un α - aminoacido essenziale proteinogenico , che si trova in piccole quantità in tutte le proteine importanti . Il nome della sostanza deriva dal latino validus per forte e sano. La valina è stata isolata per la prima volta nel 1901 da Emil Fischer dalla caseina , una proteina del latte. Strutturalmente, la valina è derivata dall'acido isovalerico sostituendo l' atomo di α- idrogeno con un gruppo amminico (-NH 2 ) .
Nella fermentazione alcolica , gli enzimi del lievito fermentano la valina per formare l' isobutanolo , un componente dell'olio di fusa (fermentazione degli aminoacidi ). Le uve raccolte tardivamente hanno un contenuto significativamente più alto di aminoacidi, compresa la valina.
isomeri
La valina ha uno stereocentro, quindi ci sono due enantiomeri . Ogni volta che "valina" è menzionata in questo testo e nella letteratura scientifica senza alcuna aggiunta, si intende sempre la L -Valin [sinonimo: ( S ) -Valin] presente in natura . In questo articolo, le informazioni sulla fisiologia si applicano anche alla sola L- valina.
| Isomeri di valina | ||
| Cognome | L -Valin | D -Valin |
| altri nomi | ( S ) -Valin | ( R ) -Valin |
| Formula strutturale |  |

|
| numero CAS | 72-18-4 | 640-68-6 |
| 516-06-3 (non specificato) | ||
| numero CE | 200-773-6 | 211-368-9 |
| 208-220-0 (non specificato) | ||
| Scheda informativa ECHA | 100.000.703 | 100.010.336 |
| 100.007.474 (non specificato) | ||
| PubChem | 6287 | 71563 |
| 1182 (non specificato) | ||
| DrugBank | DB00161 | - |
| - (non specificato) | ||
| Numero FL | 17.028 | - |
| 17.023 (non specificato) | ||
| Wikidata | Q483752 | Q27103152 |
| Q27109943 (non specificato) | ||
La valina racemica [sinonimi: DL -Valin e ( RS ) -Valin] è di importanza economica come intermedio nell'industria chimica. La D -Valin enantiomericamente pura [Sinonimo: ( R ) -Valin] è prodotta principalmente da DL -Valin ed è di importanza pratica nella produzione di ciclosporina . La racemizzazione degli L- amminoacidi può essere utilizzata per la datazione degli amminoacidi, una determinazione dell'età per il materiale osseo fossile.
L - isovalina e L - norvalina sono isomeri costituzionali .
Evento
Poiché l'organismo umano non può produrre valina, dipende dal fatto che venga fornito con il cibo. I seguenti esempi per il contenuto di valina proteinogenicamente legata si riferiscono ciascuno a 100 g di alimento; viene anche fornita la percentuale di proteine totali.
| Cibo | Proteine totali | valina | proporzione di |
|---|---|---|---|
| Manzo, crudo | 21,26 g | 1055 mg | 5,0% |
| Filetto di petto di pollo, crudo | 23,09 g | 1145 mg | 5,0% |
| Salmone, crudo | 20,42 g | 1107 mg | 5,4% |
| Uovo di pollo | 12,58 g | 859 mg | 6,8% |
| Latte vaccino, 3,7% di grassi | 3,28 g | 220 mg | 6,7% |
| Noci | 15,23 g | 753 mg | 4,9% |
| Farina integrale | 13,70 g | 618 mg | 4,5% |
| Farina di mais integrale | 6,93 g | 351 mg | 5,1% |
| Riso, non pelato | 7,94 g | 466 mg | 5,9% |
| Piselli, secchi | 24,55 g | 1159 mg | 4,7% |
| Spirulina, essiccata | 60 g | 2387 mg | 4% |
| Clorella, essiccata | 59 g | 3800 mg | 6,4% |
Tutti questi alimenti contengono quasi esclusivamente L- valina legata chimicamente come componente proteica, ma non L- valina libera .
Le stime del fabbisogno giornaliero per adulti sani variano, a seconda del metodo utilizzato, da 10 a 29 mg di valina per chilogrammo di peso corporeo.
significato biochimico
La valina è necessaria come elemento costitutivo per la biosintesi proteica , ma può anche essere utilizzata per generare energia in una dieta ricca di proteine o quando vengono mobilitate le riserve proteiche del corpo. Ad esempio, come gli altri due amminoacidi a catena ramificata di carbonio, leucina e isoleucina , la valina viene utilizzata per nutrire i muscoli . Questo svolge un ruolo durante lo sforzo prolungato o nelle fasi di fame , quando il corpo deve ricorrere alle proprie riserve. La scomposizione della valina fornisce propionil-CoA , che dopo la conversione in succinil-CoA aiuta a ricostituire il ciclo dell'acido citrico .
Presentazione ed estrazione
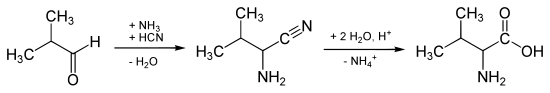
La preparazione della valina può essere effettuata mediante la sintesi di Strecker . Il prodotto di partenza è isobutanale (isobutirraldeide):
La sintesi di Strecker produce DL- valina. Per la risoluzione del racemo, la DL- valina viene acetilata sull'atomo di azoto. La DL - N- acetilvalina così formata viene sottoposta a risoluzione enzimatica . L'enzima L- acetilasi idrolizza enantioselettivamente il legame ammidico della L - N- acetilvalina ad acido acetico e L- valina, mentre la D - N- acetilvalina rimane invariata.
L- Valin può anche essere ottenuto direttamente per fermentazione , un processo utilizzato nelle biotecnologie . I materiali di partenza dipendono dalle colture batteriche utilizzate . Come richiesto Bacillus lactofermentum glucosio , acido acetico B. flavum e Corneybacterium acetoacephilum etanolo come fonte del carbonio della spina dorsale. Al fine di aumentare la resa e prevenire la formazione di prodotti indesiderati, questi sono generalmente allevati appositamente (geneticamente modificati o selezionati).
proprietà
La valina ha una catena laterale lipofila . Il coefficiente di ripartizione ottanolo-acqua è -2,26 (log K OW ). Il punto isoelettrico è 5,96, il van der Waals di volume è 105. Valina è presente principalmente come “sale interno” o zwitterion , la cui formazione può essere spiegata dal fatto che il protone del gruppo carbossilico è attaccato al doppietto di elettroni L'atomo di azoto del gruppo amminico migra.
Lo zwitterion non migra nel campo elettrico perché è completamente scarico. A rigor di termini, questo è il caso al punto isoelettrico (ad un certo valore di pH), al quale la valina ha anche la sua più bassa solubilità in acqua.
utilizzo
Come precursore (elemento costitutivo finito di una molecola di prodotto), la valina può aumentare la resa delle colture che formano penicillina .
È un componente di bevande energetiche e soluzioni per infusione per la nutrizione parenterale.
Come materiale di partenza per la produzione mirata di sostanze enantiomericamente pure , ( S )-valina è di importanza pratica in chimica.
letteratura
- Hans-Dieter Jakubke e Hans Jeschkeit: Aminoacidi, peptidi, proteine , Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2 .
- Jesse Philip Greenstein e Milton Winitz: Chimica degli aminoacidi , John Wiley & Sons, 1962, volumi da 1 a 3, ISBN 0-471-32637-2 .
- Yoshiharu Izumi, Ichiro Chibata e Tamio Itoh: Production and Utilization of Amino Acids , in: Angewandte Chemie International Edition in English 1978 , 17 , pp. 176-183. doi : 10.1002 / anie.197801761 .
link internet
Evidenze individuali
- ↑ a b c d Scheda tecnica Valine (PDF) di Merck , consultata il 25 dicembre 2019.
- ↑ Scheda tecnica della valina di Sigma-Aldrich , consultata il 22 ottobre 2016 ( PDF ).
- ^ A b Hans Beyer e Wolfgang Walter : Textbook di Chimica Organica , S. Hirzel Verlag, Stoccarda 1991, ISBN 3-7776-0485-2 ., P 823.
- ↑ una voce b su valina. In: Römpp Online . Georg Thieme Verlag, consultato il 25 dicembre 2014.
- ^ Hans-Dieter Jakubke, Hans Jeschkeit: Aminoacidi, peptidi, proteine , Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2 .
- ↑ database dei nutrienti del Dipartimento dell'Agricoltura degli Stati Uniti , 21a edizione.
- ↑ AV Kurpad, MM Regan, T. Raj, JV Gnanou: Fabbisogno di aminoacidi a catena ramificata in soggetti umani adulti sani. In: J. Nutr. 136 (1 Supplemento); gennaio 2006: pp. 256S-263S; PMID 16365094 .
- ^ JM Berg, JL Tymoczko, L. Stryer: Biochimica. 6a edizione. Casa editrice accademica Spectrum, Elsevier GmbH, Monaco di Baviera 2007; Pag. 697-698, 735, 746; ISBN 978-3-8274-1800-5 .
- ↑ C. Hansch; A. Leone; D. Hoekman: Esplorare QSAR. Costanti idrofobiche, elettroniche e steriche ACS Professional Reference Book, American Chemical Society, Washington DC, 1995; ISBN 978-0-8412-2991-4 .
- ^ PM Hardy: The Protein Amino Acids in GC Barrett (editore): Chemistry and Biochemistry of the Amino Acids , Chapman e Hall, 1985, ISBN 0-412-23410-6 , p. 9.
- ^ S. Ebel e HJ Roth (a cura di): Lexikon der Pharmazie , Georg Thieme Verlag, 1987, p.668 , ISBN 3-13-672201-9 .
- ^ Karlheinz Drauz, Axel Kleemann e Jürgen Martens: Induzione dell'asimmetria attraverso amminoacidi , in: Angewandte Chemie , 1982 , 94 , pp. 590-613; Angewandte Chemie - International Edition English , 1982 , 21 , pp. 584-608.
- ↑ Jürgen Martens : Sintesi asimmetriche con aminoacidi , in: Topics in Current Chemistry , 1984 , 125 , pp. 165-246.