Carbonato di potassio
| Formula strutturale | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
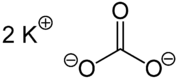
| ||||||||||||||||||||||
| Generale | ||||||||||||||||||||||
| Cognome | Carbonato di potassio | |||||||||||||||||||||
| altri nomi | ||||||||||||||||||||||
| Formula molecolare | K 2 CO 3 | |||||||||||||||||||||
| Breve descrizione |
solido bianco |
|||||||||||||||||||||
| Identificatori esterni / banche dati | ||||||||||||||||||||||
| ||||||||||||||||||||||
| proprietà | ||||||||||||||||||||||
| Massa molare | 138,20 g mol −1 | |||||||||||||||||||||
| Stato fisico |
fermamente |
|||||||||||||||||||||
| densità |
2,428 gcm -3 |
|||||||||||||||||||||
| Punto di fusione |
891 °C |
|||||||||||||||||||||
| punto di ebollizione |
decomposizione |
|||||||||||||||||||||
| solubilità |
molto leggero in acqua (1120 g l -1 a 20 ° C) |
|||||||||||||||||||||
| istruzioni di sicurezza | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Dati tossicologici | ||||||||||||||||||||||
| Proprietà termodinamiche | ||||||||||||||||||||||
| H f 0 |
−1151.0 kJ/mol |
|||||||||||||||||||||
| Per quanto possibile e consueto, vengono utilizzate unità SI . Salvo diversa indicazione, i dati forniti si applicano alle condizioni standard . | ||||||||||||||||||||||
Il carbonato di potassio (linguaggio tecnico) o carbonato di potassio ( nome comune : potassa ), K 2 CO 3 , è un alcali e il sale di potassio dell'acido carbonico . Forma una polvere igroscopica bianca con una temperatura di fusione di 891 ° C e una densità di 2,428 g · cm -3 . Il nome potassa deriva dall'antico metodo di arricchire il carbonato di potassio dalle ceneri delle piante (soprattutto cenere di legno, ma anche cenere di alghe ) lavandole con acqua (da cui il nome "sale liscivia") e poi facendole evaporare in vasi. Il nome tradizionale è stato anche l'ispirazione per i nomi inglesi potassa e potassio , per cui la potassa include molti sali minerali di potassio (ad esempio cloruro di potassio ) e dovrebbe essere tradotta meglio come sale di potassio .
Evento
I più grandi giacimenti di sale di potassio del mondo si trovano in Canada , Russia , Eritrea , Bielorussia e Germania ; Il carbonato di potassio si trova anche in alcune acque interne come il Mar Morto o il deserto di Lop Nor . In passato, la potassa era ottenuta principalmente dalla cenere di legno per lisciviazione . Il contenuto di ceneri di legno dei componenti minerali è di circa l'85%; circa il 14-19% di questo è carbonato di potassio e carbonato di sodio.
Estrazione e presentazione
- Carbonizzazione dell'idrossido di potassio :
- La principale fonte di CO 2 utilizzata sono i gas di combustione.
- Reazione del latte di calce ( soluzione di idrossido di calcio ) con solfato di potassio e monossido di carbonio a 30 bar (processo con formiato). Il formiato di potassio separato viene quindi calcinato ossidativamente:
- Lisciviazione di ceneri vegetali e successiva evaporazione in capannoni di cenere (non più storicamente o tecnicamente importanti)
- storico: bruciatura del tartaro ( Tartarus calcinatus è tartaro bruciato), per esempio in Paracelso
Come il carbonato di sodio , il carbonato di potassio non può essere ottenuto utilizzando il processo ammoniaca-soda perché il prodotto intermedio idrogenocarbonato di potassio (KHCO 3 ) è troppo solubile.
proprietà
In acqua è molto facilmente e prontamente solubile (1120 g/l), per cui si libera calore. La soluzione reagisce alcalina per formazione di ioni idrossido :
- Uno ione carbonato reagisce con l'acqua per formare uno ione idrogenocarbonato e uno ione idrossido.
Con gli acidi si formano i corrispondenti sali di potassio con lo sviluppo di anidride carbonica . A temperatura ambiente cristallizza come diidrato dalla soluzione acquosa.
Il carbonato di potassio anidro cristallizza monoclinicamente , gruppo spaziale P 2 1 / c (gruppo spaziale n. 14) con i parametri reticolari a = 5,640 Å , b = 9,839 , c = 6,874 β e β = 98,70°. A 250 ° C questo si trasforma nella forma β monoclina (gruppo spaziale C 2 / c (n. 15) , a = 5,675 , b = 9,920 Å, c = 7,018 e β = 96,8 °). A 450 ° C questo si trasforma in una forma esagonale .
uso
- Additivo nella fabbricazione del vetro
- Produzione di saponi morbidi
- Fabbricazione di bicchieri di potassio
- Fabbricazione di vernici
- Produzione di sviluppatori fotografici
- Produzione di fertilizzanti (componente che fornisce potassio)
- Il carbonato di potassio anidro viene occasionalmente utilizzato come agente essiccante in laboratorio .
- Agente lievitante per prodotti da forno piatti ( biscotti e panpepato , in particolare pasticceria natalizia) e impasti ad alto contenuto zuccherino.
- Additivo al cacao come correttore di acidità
- Agente neutralizzante quando si utilizza acido cloridrico (E 507) come esaltatore di aroma .
- Essiccazione rapida dell'uva passa: Rimuovendo lo strato di cera naturale dell'uva, l'umidità evapora più facilmente.
- Prodotto base per altri composti di potassio.
- Per togliere la crosta dalle pentole: mettere 1 cucchiaio sulla crosta nella pentola, lasciare riposare una notte e portare a bollore il giorno dopo con una tazza d'acqua; i residui si staccano dal fondo della pentola in maniera a scaglie.
- Distaccante per calchi in gesso ( scultura )
- Componente dell'elettrolita nelle celle a combustibile a carbonati fusi
- Additivo per tabacco da fiuto (in Germania secondo l' ordinanza sul tabacco )
- Additivo per l'assunzione di alcune sostanze che creano dipendenza
- Additivo in alcuni saponi liquidi lavamani
- Agente antigelo ecologico (invece del sale antigelo ) per ghiaccio nero su strade e marciapiedi
- Poiché contiene sempre potassio-40 radioattivo, il potassio può essere utilizzato per gli esperimenti degli studenti sulla radioattività
- Per molti secoli in Europa, il carbonato di potassio sotto forma di cenere di faggio è stato utilizzato per l' abbigliamento del ventre e altri tessuti di lino e successivamente anche di cotone . Le ceneri vengono messe in sacchi e aggiunte a una botte di legno piena di strati di biancheria. Versando acqua calda sulla bustina si liberava una liscivia che aveva un effetto detergente e leggermente sbiancante. La liscivia veniva quindi lavata con acqua alla fontana di lavaggio o al fiume. L'avvento del sapone di cagliata e dei successivi detersivi artificiali all'inizio del XX secolo ha reso obsoleto questo metodo.
- Parte degli agenti estinguenti
Digestione soda-potassa
La digestione soda- potassa viene utilizzata per solfati poco solubili (alcalino-terrosi), ossidi altamente ricotti (acidi o anfoteri), silicati e alogenuri d'argento; la digestione avviene in un fuso Na 2 CO 3 / K 2 CO 3 . ZrO 2 , Zr 3 (PO 4 ) 4 , Al 2 O 3 , Cr 2 O 3 e Fe 2 O 3 sono solo parzialmente disciolti. Per questa digestione a fusione viene utilizzata una miscela di soda e potassa, perché abbassa il punto di fusione rispetto ai sali puri ( miscela eutettica ). Inoltre, l'enorme eccesso di carbonato spinge l'equilibrio della reazione dal lato del prodotto.
Un esempio di solfati:
Evidenze individuali
- ↑ Voce su E 501: carbonato di potassio nella banca dati europea sugli additivi alimentari, accesso il 1 luglio 2020.
- ↑ Inserimento sul CARBONATO DI POTASSIO nel database CosIng della Commissione UE, consultato l'11 agosto 2020.
- ↑ un b c d e f g Entrata in carbonato di potassio nella banca dati delle sostanze GESTIS del l' IFA , si accede il 22 febbraio 2017. (JavaScript richiesto)
- ↑ Inserimento sul carbonato di potassio nel database ChemIDplus della National Library of Medicine (NLM) degli Stati Uniti
- ↑ David R. Lide (a cura di): CRC Handbook of Chemistry and Physics . 90a edizione. (Versione Internet: 2010), CRC Press / Taylor e Francis, Boca Raton, FL, Proprietà termodinamiche standard delle sostanze chimiche, pp. 5-20.
- ^ USGS (programma delle risorse minerarie degli Stati Uniti): Potash. (PDF; 88 kB) Da gennaio 2010.
- ↑ L'iscrizione cenere di legno. In: Lessico della chimica. Spektrum der Wissenschaft Verlagsgesellschaft, consultato il 3 settembre 2018 .
- ↑ inserimento su carbonato di potassio. In: Römpp Online . Georg Thieme Verlag, consultato il 12 novembre 2014.
- ↑ Friedrich Dobler: Il fondamento chimico della medicina di Teofrasto Paracelso: revisione sperimentale dei suoi preparati di antimonio. In: Publications of the International Society for the History of Pharmacy , New Series, 10, 1957, pp. 76-86, qui: p. 80.
- ^ Friedrich Dobler: Conrad Gessner come farmacista. Von Ostheim AG, Zurigo 195, pagina 104.
- ↑ Y. Idemoto, JW Richardson, N. Koura, S. Kohara, CK Loong: Struttura cristallina di (Li x K 1-x ) 2 CO 3 (x = 0,0.43,0.5,0.62,1) mediante diffrazione da polvere di neutroni analisi. In: Journal of Physics and Chemistry of Solids , 59, 1998, pp. 363-376, doi: 10.1016 / S0022-3697 (97) 00209-6 .
- ↑ HY Becht, B. Struikmans: una modifica monoclinica ad alta temperatura del carbonato di potassio. In: Acta Crystallographica , B32, 1976, pp. 3344-3346, doi: 10.1107 / S0567740876010303 .
- ^ SJ Schneider, EM Levin: Polimorfismo di K 2 CO 3 . In: Journal of the American Ceramic Society , 56 (4), 1973, pp. 218-219, doi: 10.1111 / j.1151-2916.1973.tb12461.x .
- ↑ Studio dell'Università delle risorse naturali e delle scienze della vita, Vienna sugli effetti degli agenti scongelanti contenenti azoto Studio sugli agenti scongelanti 2000 (PDF; 1.6 MB)
- ↑ LVR Istituto di studi regionali e storia regionale: panni da forno con frassino di faggio
- ↑ Georg Pleß: Sostituzione di alcuni agenti estinguenti dannosi per l'ambiente in aree di applicazione selezionate . Ed.: Istituto dei vigili del fuoco Sassonia-Anhalt. Heyrothsberge 2003 ( Umweltbundesamt.de [PDF]).
link internet
- Stephanie Summermatter: Potassa. In: Lessico storico della Svizzera .







