acido carbonico
| Formula strutturale | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
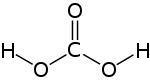
| |||||||||||||||||||
| Generale | |||||||||||||||||||
| Cognome | acido carbonico | ||||||||||||||||||
| altri nomi |
|
||||||||||||||||||
| Formula molecolare | H 2 CO 3 | ||||||||||||||||||
| Identificatori esterni / banche dati | |||||||||||||||||||
| |||||||||||||||||||
| proprietà | |||||||||||||||||||
| Massa molare | 62,03 g mol −1 | ||||||||||||||||||
| Stato fisico |
esiste solo in presenza di acqua in soluzione |
||||||||||||||||||
| p K S valore |
|
||||||||||||||||||
| istruzioni di sicurezza | |||||||||||||||||||
| |||||||||||||||||||
| Per quanto possibile e consueto, vengono utilizzate unità SI . Salvo diversa indicazione, i dati forniti si applicano alle condizioni standard . | |||||||||||||||||||
L'acido carbonico (H 2 CO 3 ) è un acido inorganico e il prodotto di reazione della sua anidride acida anidride carbonica (CO 2 ) con l' acqua . I sali dei due acidi protonici sono i carbonati e gli idrogenocarbonati . I loro esteri sono anche chiamati carbonati o esteri dell'acido carbonico . I poliesteri , che sono noti come policarbonati , sono di importanza tecnica .
Rispetto a O 2 e N 2, il gas CO 2 è relativamente solubile in acqua e reagisce in piccola misura (circa 0,2%, a seconda della temperatura e della pressione ) per formare acido carbonico:
Colloquialmente, il gas CO 2 è spesso indicato in modo impreciso come acido carbonico. Infatti, nella chimica dell'acqua, la CO 2 disciolta viene solitamente combinata con l'acido vero e proprio H 2 CO 3 come acido carbonico libero . Si oppone alla somma di carbonato e idrogenocarbonato come acido carbonico legato .
L'anidride carbonica svolge un ruolo importante nell'equilibrio acido-base dell'acqua, del sangue e dei fluidi corporei.
La natura dell'acido carbonico come anidride carbonica disciolta fu riconosciuta da William Brownrigg nel 1741 . Tuttavia, Joseph Priestley è noto per l'invenzione dell'acqua gassata (ai suoi tempi come prete a Leeds dal 1767, quando aveva abbastanza anidride carbonica da una vicina fabbrica di birra).
Equilibrio di dissociazione
L'anidride carbonica disciolta è in equilibrio con l'acido carbonico in soluzione acquosa:
- (1)
La regola di Erlenmeyer descrive l'instabilità di molecole con due gruppi ossidrile sullo stesso atomo di carbonio. Quindi l'equilibrio è molto dalla parte dell'anidride ; la proporzione della molecola acida in soluzione acquosa è solo dello 0,2% circa. Questa proporzione dipende moderatamente dalla temperatura. Negli organismi , la reazione è accelerata dall'enzima anidrasi carbonica . L'acido carbonico è un acido biprotonico . Rilascia quindi i suoi protoni in due fasi di dissociazione all'acqua o ad altre basi :
- (2)
Il valore pK s della prima costante acida può essere calcolato solo. Con deviazioni dipendenti dalla temperatura, in realtà è di circa 3,6. L'acido carbonico è quindi un acido moderatamente forte paragonabile all'acido acetico (pK s 4,76) e all'acido formico (pK s 3,77). Tuttavia, poiché è difficile determinare la proporzione di acido carbonico secondo l'equazione (1), le reazioni (1) e (2) sono combinate in (3):
- (3)
e risultano nel valore (quasi sempre citato e determinabile sperimentalmente) di circa 6,5 per il valore di pK s . L'anidride carbonica libera è quindi un acido debole. Il prodotto della reazione è lo ione idrogenocarbonato HCO 3 - .
- (4)
Il valore di pK s per la seconda costante di acidità è 10,5. Il prodotto della reazione è lo ione carbonato CO 3 2− .
Le concentrazioni delle tre (in realtà quattro) specie di acido carbonico , cioè l'acido carbonico libero (H 2 CO 3 e CO 2 disciolto ), l'idrogenocarbonato e il carbonato nonché gli ioni ossonio sono tra loro legate dalla legge di azione di massa . La concentrazione di ioni ossonio è espressa dal pH . Ad un dato pH, la proporzione delle specie è così fissata.
Indicazione del pH dell'acqua
- A pH 4, più del 99% è una miscela di anidride carbonica/acqua. (es. in acqua minerale )
- Ad un pH di 6,5, che è lo stesso del pK s della prima costante acida, c'è anche la stessa quantità di idrogenocarbonato; la quota di carbonato è ancora molto al di sotto dell'1%.
- A circa pH 7,5 nell'acqua di rubinetto, l'idrogenocarbonato in essa contenuto, insieme alla poca anidride carbonica disciolta, determina l'equilibrio acido. (il sangue umano con pH 7,4 contiene anidride carbonica e idrogenocarbonato in un rapporto di 1:24)
- A circa pH 8,3, la percentuale massima di idrogenocarbonato è di circa il 98%; L'anidride carbonica e il carbonato costituiscono ciascuno poco meno dell'1%. Questo è il pH tipico dell'idrogenocarbonato di sodio o di potassio in acqua. Anche l'acqua potabile bollita mostra questo pH, poiché l'anidride carbonica disciolta è stata espulsa.
- L'acqua potabile che è stata bollita fino quasi a secchezza ha un pH fino a 9, poiché una piccola percentuale di idrogenocarbonato viene convertita in carbonato (vedi formazione di incrostazioni ).
- Ad un pH pari al pK s della seconda costante acida di 10,5, sono presenti le stesse quantità di idrogenocarbonato e carbonato e una percentuale trascurabile di anidride carbonica.
- A pH 12,5, il carbonato ha una quota del 99%, l'idrogenocarbonato è poco meno dell'1%. Questo è il pH tipico del carbonato di sodio o di potassio in acqua.
Questi parametri di riferimento riflettono le relazioni nel tampone bicarbonato ampiamente utilizzato .
uso
L'anidride carbonica viene utilizzata per innumerevoli processi di produzione in tutto il mondo ed è probabilmente più nota ai consumatori finali di bevande analcoliche . Jacob Schweppe sviluppò un processo alla fine del XVIII secolo per mezzo del quale l'acqua può essere miscelata con l'anidride carbonica. Nel 19° secolo, l' anidride carbonica è stata aggiunta all'acqua minerale per renderla durevole. Vedere Uso dell'anidride carbonica nella tecnologia alimentare .
L'acido carbonico come sostanza pura
In laboratorio siamo riusciti a produrre acido carbonico (in senso stretto) come sostanza pura. Tuttavia, questo non ha attualmente alcuna importanza pratica. A basse temperature e in assoluta assenza di acqua o ioni metallici (entrambi catalizzano fortemente la reazione di decomposizione per formare anidride carbonica e acqua), l'acido carbonico H 2 CO 3 può essere rappresentato come un liquido limpido e incolore.
Derivati dell'anidride carbonica
Sono inoltre noti derivati organici dell'acido carbonico, quali vari esteri dell'acido carbonico. Sono facilmente accessibili attraverso la reazione del fosgene con gli alcoli. I policarbonati sono poliesteri di acido carbonico . Un altro gruppo di sostanze sono le ammidi dell'acido carbonico. Il loro composto progenitore è l' urea , una diammide dell'acido carbonico; un esempio sono gli uretani (da urea , urea). Sono esteri sostituiti della monoammide dell'acido carbonico, dell'acido carbammico ; questi sono i principali composti di materie plastiche estremamente importanti, i poliuretani .
Carbonatazione aggressiva e parenti
Un altro gruppo di nomi banali , che non denotano specie chimicamente diverse , ma piuttosto proporzioni quantitative , proviene dal campo della chimica delle acque per acque calcaree. Si noti che i seguenti termini si riferiscono a proporzioni del cosiddetto acido carbonico libero , in cui non si fa distinzione tra anidride carbonica e acido carbonico in senso stretto.
Secondo l' equilibrio calce-acido carbonico , le concentrazioni di calcio e acido carbonico sono reciprocamente dipendenti. Viene fatta una distinzione tra la quantità di anidride carbonica associata e la quantità di anidride carbonica in eccesso e (calcare) aggressiva . L' acido corrispondente mantiene il valore del pH così basso nell'equilibrio quantitativo delle specie di acido carbonico che la concentrazione dipendente del carbonato moltiplicata per quella del calcio non supera appena il prodotto di solubilità del carbonato di calcio. L'eventuale anidride carbonica libera presente è considerata in eccesso. Di questo, a sua volta, una parte potrebbe portare in soluzione ulteriore calce , quindi è (calce) aggressiva ; il resto dell'eccesso sarebbe quindi richiesto come ulteriore acido carbonico associato.
All'aumentare dei valori della durezza carbonatica, la proporzione dell'acido carbonico libero associato aumenta in modo sproporzionato. Ad esempio, questo valore è 1.83 mg / l di CO 2 a 5,1 ° dH e 11.67 mg / l di CO 2 a 10.2 ° dH . Questo porta a un problema di acqua mista durante la miscelazione dell'acqua . Miscelando acqua con diversa durezza carbonatica si ottiene acqua miscelata con acido carbonico aggressivo, anche se l'acqua di sorgente era in equilibrio calce-acido carbonico.
Le relazioni matematiche sono riassunte nell'equazione di Tillmans , con la quale si può calcolare l'“acido carbonico libero” associato per ogni contenuto di calcio. Di seguito è riportata la versione breve di questa equazione:
Gli elementi dell'equazione significano:
- = Concentrazione dell'acido carbonico libero associato (CO 2 ) da calcolare in mol/kg
- = costante di Tillman
- = Quadrato della concentrazione di idrogenocarbonati (HCO 3 ) in mol/kg
- = Concentrazione di calcio in mol/kg
Ulteriori dettagli possono essere trovati nell'equazione di Tillmans .
La conoscenza precisa di questo equilibrio e della sua velocità di presa è di grande importanza per il trattamento e la decarbonizzazione dell'acqua. Nel trattamento dell'acqua potabile, ad esempio, l'acqua grezza viene fatta passare su dolomite semicombusta (carbonato di calcio e magnesio, CaMg (CO 3 ) 2 ) in modo che non contenga "acido carbonico libero" in eccesso , come farebbero il ferro o altri metalli. reagire con esso e quindi corrodere i tubi di acciaio, ad esempio. Queste reazioni sono anche in equilibrio con i corrispondenti carbonati, a seconda della concentrazione. Quindi si parla allora z. B. di "anidride carbonica ferro-aggressiva". La dolomite viene utilizzata perché in presenza di ioni magnesio la velocità con cui si stabilisce l'equilibrio di Tillman è notevolmente accelerata, cosa che richiederebbe troppo tempo con il carbonato di calcio puro.
Per alcuni gruppi di utenti, ad es. B. nella pesca, i termini quantitativi qui menzionati sono spesso fraintesi come se z. B. l'"anidride carbonica aggressiva" sarebbe particolarmente dannosa, ad esempio per i pesci. Ma poiché i pesci non sono costituiti da calce, l'acido carbonico aggressivo non è diretto contro di loro in altro modo rispetto al resto dell'acido carbonico. Piuttosto, è la concentrazione totale di CO 2 disciolta che è decisiva per la respirazione del pesce, mentre il valore del pH dell'acqua è l'unico fattore decisivo per eventuali ustioni chimiche acide. L'“acido carbonico associato” è qui frainteso come se fosse legato in modo speciale all'idrogenocarbonato e quindi non potesse essere espulso dalla ventilazione dell'acqua o consumato dalle alghe attraverso la fotosintesi. Infatti, tutto “l'acido carbonico libero” è disponibile per entrambi i processi, per cui il valore del pH aumenta e l'equilibrio quantitativo si sposta verso più carbonato, e alla fine viene superato il prodotto di solubilità della calce, cioè la precipitazione della calce. Vedi anche bilancio calce-acido carbonico .
letteratura
- Ulrich Kölle: Tutto sull'anidride carbonica. In: Chemkon. 10, n. 2, 2003, pp. 66-68.
- Th. Loerting, Chr. Tautermann, R. T. Kroemer: Sulla sorprendente stabilità cinetica dell'acido carbonico. In: Angio. Int. Chimico Ed. 39, n. 5, 2000, pp. 891-894.
Tedesco: Th. Loerting, Chr. Tautermann, R. T. Kroemer: Alla sorprendente stabilità cinetica dell'acido carbonico. In: Angio. Chem. 112, 2000, pp. 919-922 ( doi : 10.1002 / (SICI) 1521-3757 (20000303) 112: 5 <919 :: AID-ANGE919> 3.0.CO; 2-Y ). - Kurt Bauer: Sull'importanza dell'anidride carbonica negli stagni di carpe. In: Österreichs Fischerei 44, 1991, pp. 49-64.
- Julius Pia : Anidride carbonica e calce - un'introduzione alla comprensione del loro comportamento nelle acque interne. In: Le acque interne. Vol. XIII, Schweizerbart, Stoccarda 1933, ISBN 978-3-510-40713-2 .
- HE Hömig: Fondamenti fisico-chimici della chimica dell'acqua di alimentazione. 2a edizione, Vulkan-Verlag, Essen 1963, cap. 2.25-2.30.
Evidenze individuali
- ↑ ingresso all'acido carbonico nel database CosIng della Commissione Europea, consultato il 4 marzo 2020
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Manuale di chimica inorganica . 102a edizione. Walter de Gruyter, Berlino 2007, ISBN 978-3-11-017770-1 .
- ↑ K. Adamczyk, M. Prémont-Schwarz, D. Pines, E. Pines e ETJ Nibbering: osservazione in tempo reale della formazione di acido carbonico in soluzione acquosa. In: Scienza . 2009, 326, pp. 1690-1694, doi : 10.1126 / science.1180060 . - C. Ho e JM Sturtevant La cinetica dell'idratazione dell'anidride carbonica a 25 anni . In: J. Biol. Chem. 238 , 3499-3501 (1963) PDF .
- ^ DH Ripin, DA Evans: pKa's of Inorganic and Oxo-Acids ( inglese , PDF) Estratto il 15 luglio 2014.
- ↑ Questa sostanza non è stata ancora classificata per quanto riguarda la sua pericolosità o non è stata ancora trovata una fonte affidabile e citabile.
- ↑ Rapporto: uni-protocol.de . - T. Loerting, C. Tautermann, RT Kroemer, I. Kohl, A. Hallbrucker, E. Mayer, KR Liedl: in Angewandte Chemie 2000 , 112 , 919-922. Sulla sorprendente stabilità cinetica dell'acido carbonico (H 2 CO 3 ) , doi : 10.1002 / (SICI) 1521-3757 (20000303) 112: 5 <919 :: AID-ANGE919> 3.0.CO; 2-Y .
- ↑ Sull'importanza dell'anidride carbonica negli stagni di carpe . Stampa parziale dell'originale.











