Idrossido di calcio
| Struttura di cristallo | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| __ Ca 2+ __ OH - | |||||||||||||||||||
| Generale | |||||||||||||||||||
| Cognome | Idrossido di calcio | ||||||||||||||||||
| altri nomi |
|
||||||||||||||||||
| Formula del rapporto | Ca(OH) 2 | ||||||||||||||||||
| Breve descrizione |
solido incolore, inodore |
||||||||||||||||||
| Identificatori esterni / banche dati | |||||||||||||||||||
| |||||||||||||||||||
| proprietà | |||||||||||||||||||
| Massa molare | 74,10 g · mol -1 | ||||||||||||||||||
| Stato fisico |
fermamente |
||||||||||||||||||
| densità |
2,24 g cm -3 (20 ° C) |
||||||||||||||||||
| Punto di fusione |
Si decompone a 550 ° C |
||||||||||||||||||
| solubilità |
povero di acqua (1,7 g l -1 a 20 ° C) |
||||||||||||||||||
| istruzioni di sicurezza | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Svizzera: 5 mg m -3 (misurato come polvere inalabile ) |
||||||||||||||||||
| Dati tossicologici | |||||||||||||||||||
| Per quanto possibile e consueto, vengono utilizzate unità SI . Salvo diversa indicazione, i dati forniti si applicano alle condizioni standard . | |||||||||||||||||||
Idrossido di calcio (anche: calce idrata , calce spenta , (bianca) calce idrata , calce idrata ) è l' idrossido di calcio .
Evento
L'idrossido di calcio si trova anche in natura come minerale portlandite .
Estrazione e presentazione
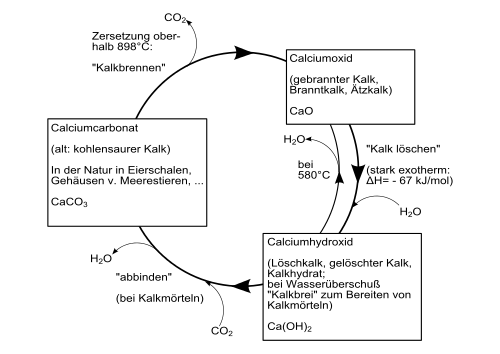
L'idrossido di calcio si forma con forte sviluppo di calore ( reazione esotermica ) quando l'ossido di calcio viene miscelato con acqua. Questo processo è anche chiamato macellazione della calce . Lo sviluppo di calore è così forte che anche parte dell'acqua evapora (chiamata colloquialmente "fumo").
Il diagramma seguente fornisce una panoramica dei processi di conversione tra i diversi composti del calcio ( ciclo tecnico della calce ) :
È anche possibile visualizzarlo facendo reagire soluzioni acquose di sali di calcio con soluzioni alcaline (ad esempio nitrato di calcio con idrossido di potassio ).
L'idruro di calcio o il calcio stesso reagisce violentemente con l'acqua per formare idrossido di calcio e idrogeno .
proprietà
L'idrossido di calcio è una polvere incolore che si dissolve solo leggermente in acqua. La solubilità dipende dalla temperatura e diminuisce all'aumentare della temperatura: 1860 mg/l a 0°C; 1650 mg/l a 20°C e 770 mg/l a 100°C. A 580°C si decompone producendo ossido di calcio e acqua. Idrossido di calcio composto da trigonali cristalli con il politipo 2H della struttura cristallina del cadmio ioduro tipo ( gruppo spaziale P 3 m 1 (gruppo spaziale No. 164) , a = 3,584, c = 4.896 Å ).
Sebbene l'idrossido di calcio non sia molto solubile, ha una reazione fortemente basica : il valore del pH di una soluzione satura è 11-12,6.
uso
Lo scopo principale dell'idrossido di calcio è la preparazione della malta nelle costruzioni. È usato lì sotto il nome di idrato di calce bianca (DIN 1060). Gli intonaci di calce sono costituiti da miscele di idrossido di calcio e sabbia. Quest'ultimo può essere aggiunto anche sotto forma di calcare macinato . Anche l'idrossido di calcio viene aggiunto sempre più spesso alla miscela di asfalto per migliorare la durata dello strato di asfalto finito.
L'idrossido di calcio si forma quando il cemento Portland si indurisce. Il cemento Portland viene utilizzato principalmente per la produzione di cemento armato . L'effetto alcalino dell'idrossido di calcio nel calcestruzzo impedisce all'acciaio di armatura di arrugginire fino a quando non viene neutralizzato dall'acido carbonico (o da altri componenti acidi dell'acqua piovana, per esempio).
L' effetto antisettico , caustico, che ostacola la crescita di agenti patogeni e muffe , è il motivo per cui in precedenza veniva utilizzata la calce spenta per disinfettare le stalle (la "calce" delle stalle).
In combinazione con la soda e il sapone lubrificante , il calcare a guscio spento viene trasformato in Tadelakt , un intonaco di calce idrofobo per ambienti umidi .
La calce viene utilizzata per migliorare la capacità portante del cantiere. Un terreno con un contenuto idrico troppo elevato e la conseguente bassa capacità portante e scarsa compattabilità può essere migliorato mescolando in calce MA 2-4%. La calce lega parte dell'acqua e quindi migliora, tra l'altro, plasticità, comprimibilità e capacità portante. Ecco perché il miglioramento del suolo con la calce è un metodo per migliorare immediatamente la facilità di installazione e la facilitazione dei lavori di costruzione.
La calce spenta viene utilizzata come alternativa al calcare nella desolforazione dei fumi , in quanto forma solfato di calcio (gesso) con acido solforico . La quantità utilizzata è circa 1,8 volte inferiore a quella del calcare. L' intonaco risultante ha un punto di bianco dell'80% e può essere utilizzato commercialmente. Data la sua elevata reattività, sono richieste quantità di consumo inferiori. Lo svantaggio è il prezzo più alto rispetto al calcare.
Nell'industria alimentare viene aggiunto agli alimenti come regolatore di acidità ed è generalmente approvato nell'UE come additivo alimentare con la designazione E 526 senza restrizioni di quantità massima ( quantum satis ) per gli alimenti.
È anche usato come medicinale in odontoiatria , principalmente per disinfettare i canali radicolari e le cavità e per stimolare la formazione di nuova dentina .
Fa parte della calce sodata , che viene utilizzata nelle macchine per anestesia o nelle macchine subacquee con rebreathing per eliminare l' anidride carbonica dall'aria espirata.
L'idrossido di calcio è anche usato come pesticida nella frutticoltura . Qui viene utilizzato, ad esempio, come fungicida (un agente contro le infestazioni fungine, come il cancro degli alberi ).
Calce acqua è il (quasi) satura soluzione di idrossido di calcio e serve come un liquido per il rilevamento di anidride carbonica attraverso la formazione di carbonato di calcio , che precipita e rende la torbida soluzione.
Le sospensioni in acqua sono:
- Calce grassa ( sump lime ): una massa cremosa e rigida - materiale da costruzione: malta di calce
- Latte di calce : un liquido biancastro, lattiginoso che si separa in sumpcalce e calce color acqua- calce , neutralizzazione degli acidi, decarbonizzazione , desolforazione dei fumi
L'idrossido di calcio viene utilizzato come prodotto intermedio nella produzione di calce clorurata e soda caustica dalla soda .
istruzioni di sicurezza
La calce bruciata (non spenta) ( ossido di calcio , calce viva) e la calce spenta sono irritanti, il contatto con gli occhi può causare gravi lesioni oculari. Una soluzione acquosa di idrossido di calcio è alcalina e leggermente corrosiva. La calce viva può provocare incendi se esposta all'acqua a causa dello sviluppo di calore.
Storico
La reazione esotermica della calce spenta era considerata uno dei più grandi enigmi quotidiani dall'antichità alla prima età moderna e trovava un'ampia varietà di spiegazioni: mentre il padre della chiesa Agostino d'Ippona (354-430) nel suo " stato di Dio " (21 , 4) il fenomeno come guardando una sorta di prova di Dio , i filosofi naturali hanno cercato di interpretare il fenomeno secondo le loro rispettive idee. Esempi importanti sono:
Seneca il Giovane e lo Stoa
Secondo la cosmologia stoica , il filosofo romano Seneca il Giovane († 65 d.C.) interpretò la macellazione della calce secondo la teoria dei quattro elementi di Aristotele . L' ossido di calcio è per lui una sorta di "pietra infuocata" dopo la combustione, che cede calore all'acqua che lo penetra.
Vitruvio e i materiali da costruzione antichi
Nel secondo libro dei suoi "Dieci libri sull'architettura" scritto intorno al 30 aC, l' antico capomastro Vitruvus formulò una scienza dei materiali da costruzione che corrispondeva alla comprensione del suo tempo . Lì, nella 2a e 5a sezione, cerca di trovare una spiegazione conclusiva dello spegnimento della calce. Per fare ciò, combina l' atomismo greco di Democrito ed Epicuro con i modelli geometrici della materia di Pitagora per creare una teoria della materia completamente separata: per Vitruvio il mondo consiste sia di " atomi " che di vuoto (secondo Democrito/Epicuro) e quattro elementi, che però (secondo Pitagora) sono solidi geometrici. Quindi per lui gli "atomi" sono identici ai corpi pitagorici e si muovono nello spazio vuoto. Quando bruciano la calce, gli "atomi d'acqua e d'aria" lasciano il calcare, che è pensato come una struttura reticolare fatta di corpi pitagorici , così che si creano "buchi". Vitruvio spiega la perdita di peso durante la combustione. Gli “atomi di fuoco”, invece, sono immagazzinati. Durante lo spegnimento, gli "atomi d'acqua" penetrano attraverso i "fori" nel grumo di calce e il "fuoco" immagazzinato fuoriesce. Poiché il materiale stesso rimane inalterato, l'adesione della sabbia nella malta avviene esclusivamente attraverso i pori così creati. Mentre questa spiegazione era sufficiente per la pura pratica edilizia, l'incompatibilità dei sistemi combinati da Vitruvio - l' atomistica non conosce "corpi atomici" geometricamente diversi, simili a blocchi di costruzione - specialmente i teorici dell'architettura del Rinascimento che si riferivano a lui, come Cesare Cesariano e Daniele Barbaro , hanno posto ulteriori enigmi.
Scaligero e Cardano
Nel XVI secolo, due dei più grandi eruditi del loro tempo, Giulio Cesare Scaligero e Gerolamo Cardano , intrapresero una faida per diversi anni e pubblicarono libri sull'esatta natura del mondo. Mentre Gerolamo Cardano vedeva la materia come un continuum infinito, che variava solo nella sua “densità” da luogo a luogo, Scaligero riteneva che il “ vuoto ” fosse il fattore determinante per il cosmo e la causa di ogni movimento. Nella sua opera principale, De subtilitate ad Cardanum (1557), che è diretta contro l'avversario , Scaligero introduce questa comprensione della materia ( Exercitatio, 5,8-9 ) usando nient'altro che "l'enigma della calce spenta": poiché il un pezzetto di calce assorbe l'acqua quando viene spento, i suoi pori possono contenere solo un “vuoto”, poiché “aria” non può fuoriuscire verso l'alto davanti ad essa, in quanto incontrerebbe immediatamente altra “aria” e quindi si bloccherebbe.
Evidenze individuali
- ↑ Inserimento su IDROSSIDO DI CALCIO nel database CosIng della Commissione UE, consultato il 24 febbraio 2020.
- ↑ Voce su E 526: Idrossido di calcio nel database europeo degli additivi alimentari, consultato il 27 giugno 2020.
- ↑ a b c d e scheda tecnica idrossido di calcio (PDF) di Merck , consultata il 4 aprile 2012.
- ↑ un b c d all'e L'iscrizione idrossido di calcio nella banca dati delle sostanze GESTIS del l' IFA , si accede il 10 gennaio 2017. (JavaScript richiesto)
- ↑ Cassa svizzera di assicurazione contro gli infortuni (Suva): valori limite - valori MAK e BAT attuali (ricerca 1305-62-0 o idrossido di calcio ), accesso il 2 novembre 2015.
- ↑ a b c Georg Brauer (Ed.), Con la collaborazione di Marianne Baudler e altri: Handbook of Preparative Inorganic Chemistry. 3a edizione riveduta. Volume II Ferdinand Enke, Stoccarda 1978, ISBN 3-432-87813-3 , pagina 926.
- ↑ Roland Pfestorf, Heinz Kadner: Chimica: un libro di testo per le università. ISBN 978-3-81711783-3 , pagina 368.
- ↑ Sostanze chimiche in brossura , 3a edizione. Harri Deutsch, Francoforte a. M., 2007.
- ↑ Dr-Luthardt.de: valore del pH e prodotto di solubilità dell'idrossido di calcio , consultato il 21 novembre 2019.
- ^ Articolo tratto da asfalto 4/2010 su schaeferkalk.de: Calce idrata nell'asfalto. , Estratto il 28 febbraio 2017.
- ↑ Felix Henke / Laura Thiemann, Vitruvio su stucco e gesso - i passaggi rilevanti dei 'decem libri de architectura' , in: Firmitas et Splendor. Vitruvio e le tecniche della decorazione murale , ed. di Erwin Emmerling, Andreas Grüner et al., Monaco 2014 (studi della Cattedra di Restauro, Università Tecnica di Monaco , Facoltà di Architettura) ISBN 978-3-935643-62-7 , pp. 13-125, lì p. 55 .
- ↑ Thomas Reiser, La lisciviazione della calce secondo le teorie antiche e rinascimentali della materia. Note su Vitruvio 2, 2 e 2, 5. Di Cesariano e Barbaro sulla faida tra Scaligero e Cardano , in: Firmitas et Splendor (2014), pp. 299-319, ivi pp. 303-304.
- ↑ Henke/Thiemann (2014), pp. 57–59; Reiser (2014), pp. 306-312.
- ↑ Reiser (2014), pp. 314-317.