reserpina
| Formula strutturale | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Generale | ||||||||||||||||||||||
| Nome non proprietario | reserpina | |||||||||||||||||||||
| altri nomi |
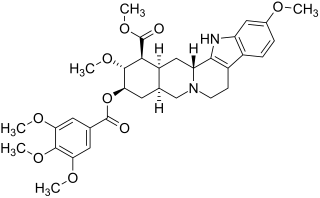
(1 S , 2 R , 3 R , 4a S , 13b R , 14a S ) -2,11-dimetossi-3- (3,4,5-trimetossibenzoilossi) 1,2,3,4,4a, 5.7, 8 ,13,13b, 14,14a-dodecaidroindolo [2 ', 3': 3,4] pirido [1,2- b ] estere metilico dell'acido isochinolin-1-carbossilico ( IUPAC ) |
|||||||||||||||||||||
| Formula molecolare | C 33 H 40 N 2 O 9 | |||||||||||||||||||||
| Breve descrizione |
polvere cristallina o piccoli cristalli, da bianco a giallo pallido, che si scuriscono lentamente sotto l'influenza della luce |
|||||||||||||||||||||
| Identificatori esterni / banche dati | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Informazioni sui farmaci | ||||||||||||||||||||||
| Codice ATC | ||||||||||||||||||||||
| Classe di farmaci | ||||||||||||||||||||||
| proprietà | ||||||||||||||||||||||
| Massa molare | 608,68 g · mol -1 | |||||||||||||||||||||
| Stato fisico |
fisso |
|||||||||||||||||||||
| Punto di fusione |
264-265 ° C |
|||||||||||||||||||||
| solubilità |
quasi insolubile in acqua |
|||||||||||||||||||||
| istruzioni di sicurezza | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Dati tossicologici | ||||||||||||||||||||||
| Per quanto possibile e consueto, vengono utilizzate unità SI . Salvo diversa indicazione, i dati forniti si applicano alle condizioni standard . | ||||||||||||||||||||||
La reserpina è un composto chimico naturale che viene utilizzato come sostanza medicinale . È un alcaloide indolo di alcune piante del gruppo delle radici del serpente , che ha trovato la sua strada nella medicina occidentale principalmente attraverso la Rauvolfia serpentina della medicina indiana.
La reserpina è uno di quei farmaci che hanno dato inizio all'era della moderna psicofarmacologia . Utilizzato per la prima volta in psichiatria come neurolettico per la schizofrenia , divenne particolarmente importante come rimedio per l'ipertensione . Sebbene sia ancora di grande importanza nella ricerca neurochimica come risultato della ricerca sul suo meccanismo d'azione , oggi ha in gran parte perso la sua importanza clinica: dopo l'introduzione di farmaci molto più efficienti, la reserpina non è più il farmaco di scelta.
origine
La reserpina si ottiene dalle radici delle piante rampicanti della sottofamiglia Rauvolfiae , principalmente dalla radice di serpente indiano (Rauvolfia serpentina) , che ha un contenuto di reserpina dello 0,04-0,05%, ma anche dalla Rauvolfia messicana heterophylla e dalla corteccia amara australiana ( " Iodustrauch"; Tabernaemontana orientalis , anche Asternia constricta ). Un'importante fonte alternativa oggi è la Rauvolfia vomitoria africana .
storia
In India, la radice di Rauvolfia serpentina , lì conosciuta anche come "Sarpagandha" , che contiene anche yohimbina , è stata usata per secoli principalmente come sedativo , ma anche come panacea. All'inizio del XX secolo, è stato riferito che uno dei venti o più alcaloidi della pianta aveva un effetto antipertensivo. Il primo articolo che trattava dell'uso psichiatrico della reserpina fu pubblicato nel 1931 dagli indiani Sen e Bose, che riportarono buoni risultati di trattamento per malattie mentali con sintomi violenti e maniacali. Nel 1949, un rapporto di Rustom Jal Vakil sul "British Health Journal" rese noti gli effetti antipertensivi della Rauvolfia anche nel mondo occidentale.
La reserpina è stata isolata per la prima volta da Rauvolfia serpentina nel 1952 da Emil Schlittler . Poco tempo dopo riuscì anche a chiarire la struttura chimica. Due anni dopo è stato raccomandato e utilizzato clinicamente per la prima volta dallo psichiatra americano Nathan S. Kline per il trattamento delle psicosi - due anni dopo la clorpromazina , contro la quale alla fine non è riuscito a imporsi come agente nelle psicosi schizofreniche, sebbene la reserpina fosse temporaneamente utilizzato dopo il 1952 divenne uno dei preparati più strettamente correlati (nome commerciale: Serpasil ) nel trattamento delle malattie psichiatriche. Nello stesso anno, von Freis fu il primo a riferire su pazienti che erano diventati depressi dopo la somministrazione di dosi elevate. Nel 1958 Robert Burns Woodward pubblicò la prima sintesi totale di reserpina. Nel Regno Unito, la reserpina è stata ritirata dal mercato per diversi anni a causa dei suoi enormi effetti collaterali . Tuttavia, il noto psichiatra Manfred Bleuler scrisse nel 1969 che l'effetto della reserpina sui malati cronici era in singoli casi più duraturo di quello della clorpromazina. Per ridurre gli effetti collaterali motori, nel 1958 è stata introdotta sul mercato una combinazione con l' orfenadrina (nome commerciale Phasein ). Alla fine degli anni '70, la reserpina è stata ampiamente sostituita da nuovi e migliori principi attivi.
L'importanza della reserpina risiede - tenuto conto del fatto che è stata ampiamente sostituita da sostanze migliori in terapia - soprattutto nella sua influenza sulla ricerca di base nella moderna neuropsicofarmacologia e neuropsichiatria: la reserpina e il suo meccanismo d'azione sono stati introdotti negli anni '50 e '60 intensamente ricercato, che ha portato a molte nuove intuizioni sui processi biochimici , come il metabolismo delle ammine biogene, la scoperta di concentrazioni regionalmente ridotte del neurotrasmettitore dopamina nel SNC nei pazienti di Parkinson o la preparazione per lo sviluppo di numerosi antidepressivi basati sull'osservazione dell'antagonismo della reserpina l'inibitore MAO iproniazide e l' imipramina triciclica .
In Germania non sono più presenti sul mercato preparati contenenti reserpina. Gli unici due preparati che erano tra i 3000 più frequentemente prescritti nel 2006 erano Briserin N (combinazione con il diuretico tiazidico Clopamid , Novartis ) e Triniton (combinazione con il farmaco antiipertensivo diidralazina e il diuretico idroclorotiazide , Apogepha ). Tuttavia, la frequenza delle prescrizioni è diminuita negli anni: rispetto al rispettivo anno precedente, la prescrizione medica di Briserin N è diminuita del 13,1% nel 2005 ed è scesa a 29,5 milioni DDD, nell'anno successivo del 14,5% a 25,2 milioni DDD; a Triniton è diminuito del 6,9% nel 2005 e di un ulteriore 16% nel 2006, scendendo inizialmente a 6,9 milioni, poi a 5,8 milioni di DDD.
I farmacologi Hartmut Porzig e Stefan Engelhardt suggeriscono che il farmaco sarebbe caduto in discredito meno, non si potevano in precedenza dosi così elevate (sono state aggiunte alla terapia antipertensiva fino a 5 mg al giorno, per neurolettici fino a 20 mg) con un lato corrispondentemente pronunciato effetti somministrati, ma quantità significativamente inferiori e allo stesso tempo sufficientemente efficaci. Le dosi giornaliere abituali oggi sono comprese tra 0,05 mg e 0,25 mg nel trattamento dell'ipertensione. Dosaggi da 1 a 2 mg al giorno sono stati comuni nel trattamento della schizofrenia.
Ci sono stati tentativi di sviluppare derivati della reserpina che dovrebbero essere meglio tollerati rispetto ai loro predecessori. Un approccio per questo, il metonitrato di reserpina, è stato presentato dagli indiani Sreemantula, Boini e Nammi nel 2004.
farmacologia
Meccanismo di azione
L'effetto della reserpina sull'organismo dei mammiferi può essere suddiviso in una componente periferica e una centrale . Mentre il primo è fondamentale per abbassare la pressione sanguigna, il secondo è responsabile degli effetti, a causa dei quali la reserpina è stata inizialmente utilizzata come neurolettico, ma ora è obsoleta.
L'effetto antipertensivo si basa su una deplezione del neurotrasmettitore noradrenalina nel sistema simpatico postgangliare . Pertanto, sebbene le cellule nervose simpatiche centrali si scarichino più frequentemente di prima, l'eccitazione non può continuare alla periferia. Come conseguenza di questa inibizione del sistema nervoso simpatico, oltre ad una riduzione della frequenza cardiaca ( bradicardia ), si può osservare anche la desiderata riduzione della pressione sanguigna . L'effetto antipsicotico della reserpina è stato collegato a una diminuzione osservata dei livelli di dopamina e serotonina nel sistema nervoso centrale. Con una potenza neurolettica di 20-50 CPZi, è uno dei neurolettici più potenti.
A livello cellulare, il meccanismo d'azione della reserpina si basa sulla “deplezione” di ammine biogene come le sostanze messaggere dopamina, serotonina e noradrenalina. Si lega ai non selettivi trasportatori monoamine vescicolari nelle membrane delle vescicole stoccaggio delle terminazioni nervose presinaptici , dopo di che le sostanze messaggere non possono più essere assorbiti nelle vescicole. In particolare inibisce la nuova sintesi della noradrenalina dalla dopamina, poiché questa avviene all'interno delle vescicole. Al di fuori di questo, le ammine biogene vengono scomposte dall'enzima monoamino ossidasi ("MAO") in aldeidi , ammoniaca e perossido di idrogeno , il che significa che la quantità di noradrenalina che può essere rilasciata quando viene risvegliata è ridotta. Dosi eccessive portano a danni irreversibili alle vescicole di stoccaggio, che devono poi essere riformate, il che richiede alcuni giorni o settimane.
farmacocinetica
La reserpina ingerita per via orale entra prima nello stomaco e da lì nell'intestino dove viene rapidamente assorbita . Il tasso di assorbimento è aumentata con un più alto valore di pH del succo gastrico , perché lo stomaco non solo è svuotato più rapidamente, ma la reserpina debolmente basico è anche meno protonato e nell'intestino - il cui ambiente è già relativamente alcalino - è in definitiva meno elettricamente carico , il che significa che può essere assorbito meglio dalle cellule intestinali. Raggiunge quindi per la prima volta il fegato attraverso la vena porta ed è quindi soggetto sia ad un effetto di primo passaggio che ad una circolazione enteroepatica ; Come risultato, reserpina, che è solo 50-60% disponibile , ha due emivite di 4.5 he 270 h. Le concentrazioni massime della sostanza nel sangue si riscontrano circa una o due ore dopo l'applicazione. Il 96% della reserpina è legato alle proteine plasmatiche , principalmente all'albumina , ma anche in una certa misura alle lipoproteine . La reserpina raggiunge il tessuto nervoso periferico e centrale attraverso il flusso sanguigno , dove dispiega il suo effetto medicinale. Poiché il legame alle vescicole neuronali è irreversibile, sono necessarie quantità relativamente piccole dell'alcaloide per "deaccumulare" quantità molto grandi di ammine da esse. L'effetto della frazione legata sopravvive quindi alla diminuzione generale della concentrazione nel tessuto. Poiché tali piccole quantità non potevano essere rilevate con mezzi precedenti, si è erroneamente ipotizzato che la durata dell'effetto della sostanza superasse significativamente quella della sua effettiva presenza nel sito di azione. Questo fatto ha coniato il suo nome come droga mordi e fuggi . Inoltre, la parte del leone della reserpina viene metabolizzata e quindi escreta principalmente con le feci (circa il 60% entro quattro giorni), in parte anche nelle urine (circa l'8%).

Per eliminazione avviene una conversione enzimatica nell'intestino e nel fegato, che produce sostanze polari e quindi più facilmente escrebili. I principali metaboliti - reserpate metile , acido trimetossibenzoico (TMBS) e, in misura minore, acido reserpic - sono prodotte da esterasi scissione mediata dei due legami esterei di reserpina. Oltre a questa degradazione idrolitica , catalizzata da enzimi epatici microsomiali , avviene la demetilazione ossidativa del gruppo metossi medio del residuo TMBS. Il prodotto può quindi essere idrolizzato più facilmente dall'organismo, formando acido siringico al posto del TMBS . Rispetto alla sostanza di partenza, i metaboliti sono farmacologicamente largamente inattivi.
Il metonitrato di reserpina (RMN) attraversa la barriera emato-encefalica a causa dell'ammina quaternizzata - un'ammina che è legata in modo covalente a quattro atomi di carbonio e quindi porta una carica positiva - significativamente più difficile, il che significa che nel SNC si trova una quantità significativamente inferiore di sostanza rispetto a è il caso della reserpina e gli effetti collaterali sul sistema nervoso centrale (sintomi di Parkinson, sedazione) sono notevolmente ridotti.
Indicazione e applicazione
L'uso terapeutico della reserpina è valutato in modo molto diverso negli attuali libri di testo sullo sfondo di questi effetti collaterali. Mentre in alcune basse dosi di reserpina ben tollerate e la sua idoneità è evidenziata come un partner di combinazione con una terapia inadeguata con un singolo altro agente antipertensivo, altri autori rifiutano completamente la reserpina, in particolare il contrasto di Martin Wehling , sostiene e lamenta che ci sono ancora "in un preparazione molto apprezzata che spesso viene prescritta per il suo basso prezzo” . La commissione sui farmaci della professione medica tedesca effettua anche la prescrizione continua di Briserin N ® e Triniton ®, tra gli altri. torna a bassi costi terapeutici giornalieri, ma ritiene più economico e più sensato limitarsi inizialmente ai diuretici. Sottolinea, tuttavia, che i pazienti che sono già ben adattati alle preparazioni di combinazione di reserpina e che tollerano bene questo farmaco non hanno motivo di cambiare nulla su di loro. L'ultimo preparato di reserpina in Germania ( Briserin N) è stato ritirato dal mercato nel 2016.
La reserpina può essere utilizzata a livello diagnostico per confermare il sospetto di un carcinoide . Questa prova reserpina è una provocazione prova finalizzata alla attività endocrina del tumore : Il tumore produce grandi quantità di serotonina, che viene rilasciata dalle cellule tumorali da reserpina e sintomi tipici di carcinoidi compreso un drastico aumento della concentrazione di prodotto serotonina Breakdown 5 -HIES nelle urine.
La reserpina è generalmente controindicata nei pazienti con una storia di episodi depressivi, ulcere gastriche e duodenali esistenti e asma bronchiale .
Oggi la reserpina viene solitamente somministrata per via orale come agente ipotensivo nella terapia a lungo termine , ma le iniezioni intramuscolari erano comuni anche nel precedente uso psichiatrico .
La reserpina è raccomandata negli Stati Uniti dal Joint National Committee (JNC 8) come farmaco alternativo per il trattamento dell'ipertensione. Una revisione Cochrane ha rilevato che la reserpina è efficace quanto altri farmaci antipertensivi di prima linea nel ridurre la pressione sanguigna. La combinazione di reserpina con un diuretico tiazidico è uno dei pochi trattamenti farmacologici che riducono la mortalità negli studi randomizzati controllati, ad es. Come il programma per il rilevamento e il follow-up dell'ipertensione ( The Hypertension Detection and Follow-up Program ), il Veterans Administration Cooperative Study Group sugli agenti antipertensivi e il programma per l' ipertensione sistolica negli anziani . Inoltre, la reserpina è stata inclusa come opzione antipertensiva secondaria per i pazienti che non hanno raggiunto gli obiettivi antipertensivi nello studio ALLHAT. La dose giornaliera di reserpina nel trattamento antipertensivo è solo di 0,05-0,25 mg.
La reserpina veniva usata negli Stati Uniti per trattare i sintomi della discinesia nei pazienti con malattia di Huntington , ma ora si preferiscono farmaci alternativi.
L'uso della reserpina come farmaco antipsicotico era stato quasi completamente abbandonato, ma recentemente è tornato come trattamento concomitante in combinazione con altri antipsicotici, così che i pazienti più refrattari ricevono il blocco della dopamina dall'altro antipsicotico e la deplezione della dopamina da reserpina. I dosaggi possono essere mantenuti bassi, il che porta a una migliore tollerabilità. In origine, per il trattamento delle malattie psicotiche venivano utilizzate dosi da 0,5 mg a 40 mg al giorno. Dosaggi superiori a 3 mg al giorno, che spesso richiedono l'uso di un farmaco anticolinergico per trattare gli effetti colinergici eccessivi in diverse parti del corpo o il morbo di Parkinson . Per il trattamento concomitante, le dosi sono generalmente mantenute pari o inferiori a 0,25 mg due volte al giorno.
Medicina Veterinaria
La reserpina è usata come sedativo a lunga durata per calmare cavalli irritabili o problematici ed è stata usata illegalmente per sedare cavalli da competizione , cavalli in vendita e altre situazioni in cui si desidera un cavallo più calmo.
Effetto antibatterico
La reserpina inibisce la formazione di biofilm di Staphylococcus aureus e inibisce l'attività metabolica dei batteri nei biofilm.
Effetti collaterali e interazioni
Come con la maggior parte degli antisimpaticotonici, la somministrazione di reserpina può avere una serie di gravi effetti collaterali . Poiché la reserpina riduce la disponibilità di catecolamine e quindi abbassa il tono simpatico, ma l' acetilcolina - che ha un proprio vettore per l'ingresso nelle vescicole - lascia intatta, predomina l'attività del sistema nervoso parasimpatico , e costrizione della pupilla , piaghe cadenti , gonfiore del mucosa nasale (attraverso la secrezione sierosa in questi, la cosiddetta "rinite da reserpina"), si verificano perdita di libido e potenza, diarrea , ulcere gastriche e duodenali . Per gli stessi motivi, oltre alla bradicardia a causa della regolazione riflessa alterata della pressione sanguigna, può verificarsi un calo della pressione sanguigna correlato alla posizione , che può essere così grave, specialmente quando il corpo viene raddrizzato rapidamente, che si verifica improvvisamente l'incoscienza . La gittata cardiaca , ridotta dalla reserpina, si normalizza nuovamente con la somministrazione cronica, poiché la resistenza vascolare diminuisce con la pressione sanguigna .
La reserpina può entrare nel latte materno e danneggiare il feto. I bambini le cui madri hanno assunto reserpina nell'ultimo trimestre di gravidanza soffrono più spesso di bere e di disturbi respiratori in seguito, i neonati possono essere letargici e può verificarsi bradicardia nel feto . La reserpina può anche causare crampi mestruali .
Nel SNC è particolarmente evidente la carenza di dopamina e serotonina, che può portare a disturbi motori extrapiramidali , parkinsonismo , sedazione e stati d'animo depressivi fino al suicidio .
Paul Willner sottolinea , tuttavia, che la diffusa convinzione che la reserpina causi la depressione si basa su una serie di rapporti degli anni '50 di Goodwin et al. sarebbe stato mal diagnosticato. Avevano rivalutato i dati su cui si basavano i rapporti di allora e sono giunti alla conclusione che i pazienti trattati con reserpina tendevano a mostrare pseudo- depressione , che è caratterizzata da rallentamento psicomotorio , affaticamento e anedonia , ma non sintomi cognitivi della depressione. come Sentito senza speranza o colpevole . Solo il 5-9% dei pazienti avrebbe mostrato sintomi di depressione primaria, e questi avrebbero anche avuto una storia di disturbi affettivi .
In caso di sovradosaggio tossico , la frequenza del battito cardiaco, la pressione sanguigna e la temperatura corporea diminuiscono (che può essere preceduta da un aumento della pressione sanguigna e della frequenza cardiaca), le mucose si gonfiano e si verifica sonnolenza e possono verificarsi anche crampi .
La precedente somministrazione di antidepressivi triciclici o tetraciclici porta a un effetto noto come inversione della reserpina : i farmaci triciclici e tetraciclici impediscono ai trasmettitori già rilasciati nello spazio sinaptico di essere riassorbiti nelle terminazioni nervose presinaptiche, che non solo aggirano l'effetto reserpina, ma anche l'eccitazione motoria è addirittura aumentato. I simpaticomimetici indiretti non funzionano dopo il pretrattamento con reserpina , mentre l'effetto dei simpaticomimetici diretti e degli inibitori della monoamino ossidasi è aumentato dalla reserpina. Aumenta il livello di zucchero nel sangue effetto di abbassare i farmaci antidiabetici , mentre l'antiparkinson effetto di bromocriptina e levodopa può essere interrotto. Se si assumono contemporaneamente narcotici , oppiacei o alcol , gli effetti sedativi delle sostanze si rafforzano a vicenda; L'effetto ipotensivo è aumentato in combinazione con vasodilatatori e diuretici tiazidici . Quest'ultimo viene utilizzato terapeuticamente: attraverso la combinazione fissa di reserpina con diuretici, che hanno un meccanismo d'azione completamente diverso, ma anche una pressione sanguigna più bassa, sono sufficienti dosi significativamente più basse, che si associano anche a una significativa riduzione degli effetti collaterali. Quando si assumono contemporaneamente fenotiazine , si verifica un aumento dell'effetto neurolettico, senza influenzare l'effetto sulla pressione sanguigna . In caso di assunzione contemporanea di glicosidi cardiaci , possono verificarsi aritmie cardiache dovute all'intensificazione dell'effetto di questi ultimi .
chimica
La reserpina è un alcaloide indolo della serie epialloyohimbane, il che significa che la sua struttura di base corrisponde a quella della yohimbina , ma gli anelli C e D così come gli anelli D ed E sono legati in cis . Questo pentaciclico backbone - che contiene già la struttura di piombo le triptamine - è quella del dell'acido reserpic . È doppiamente esterificato : il gruppo acido in C-16 è metilato , il gruppo idrossile dell'acido di riserp in C-18 è esterificato con acido 3,4,5-trimetossibenzoico .
Entrambi gli esteri sono importanti per l'attività farmacologica della reserpina. Le scissioni degli esteri che avvengono in vivo come parte del metabolismo possono essere effettuate anche in vitro . L'estere metilico dell'acido di Reserp può essere ottenuto selettivamente mediante idrolisi in condizioni blande.
Reserpina è una debole di base , in cui l'atomo di azoto di N-4 con un pK s valore di 6,6 (a 25 ° C) avente la più alta basicità, di conseguenza, si verifica l'assunzione di protoni . Con un coefficiente di ripartizione ottanolo-acqua (log K OW ) di 3,3, è una sostanza chiaramente lipofila . Di conseguenza, non si scioglie in acqua, ma si scioglie ottimamente in cloroformio , ma questa soluzione dell'alcaloide labile ha una breve durata, soprattutto alla luce del giorno, mentre la soluzione in etanolo è più difficile, ma è la più favorevole dei solventi organici in termini di stabilità.
La polvere fine e cristallina, come la reserpina, si colloca tra il bianco, il giallastro e un marrone giallastro pallido, ma diventa gradualmente più scuro sotto l'influenza della luce.
La reserpina ha un angolo di rotazione specifico da -116 ° a -128 ° a 20 ° C alla luce di sodio.
Analisi
Varie reazioni di colore possono essere effettuate con reserpina. In una soluzione di acido acetico , l' idrogeno viene scisso con nitrito di sodio , ottenendo la 3,4-deidroreserpina. Questo è un composto di anidronio fluorescente giallo-verde , che ha un massimo di assorbimento a onde lunghe di 388 nm. La stessa reserpina assorbe al massimo a 296 nm.
biosintesi
La biosintesi della reserpina inizia - così come tutti gli altri alcaloidi Epiyohimban - dalla strictosidina . Questo è creato dalla condensazione di tipo Mannich da triptamina e secologanin .
La strittosidina viene convertita in 3-epi-deidrocorynantheinaldeide. Per questo viene prima epimerizzato in C-3 , il β- D- glucosio viene scisso idroliticamente , l' ultimo anello D viene chiuso e l' ultimo anello E viene aperto. L'ordine in cui avvengono queste reazioni è ancora sconosciuto.
Quindi la 3-epi-deidrocorynantheinaldeide viene convertita in estere metilico dell'acido di riserp in tre fasi di reazione:
Innanzitutto, il doppio legame a N-4 è idrogenato stereospecificamente in modo che sia presente l'aldeide 3-epi-corynanthine. Quindi l'ultimo anello E tra C-17 e C-18 viene chiuso e il doppio legame risultante tra C-19 e C-20 viene idrogenato. Infine, dopo idrossilazione in C-18 e aggiunta di due gruppi CH 3 O, si forma metil reserpato.
Infine, il metile reserpato viene esterificato con 3,4,5-trimetossibenzoil- CoA sul gruppo ossidrile in C-18 per formare reserpina.
Sintesi totale
Sebbene la reserpina sia principalmente isolata dalle specie Rauvolfia, è possibile una produzione completamente sintetica. In una sintesi che coinvolge 16 fasi di reazione, Woodward è riuscito nel 1958 nella prima preparazione (costituzionale) di reserpina. Nel 1958, la sintesi totale della reserpina fu una pietra miliare nella chimica organica . Per la sua struttura complessa, è diventato un classico e il bersaglio di numerose sintesi totali. Un modo di sintesi totale stereospecifica è stato stabilito nel 1989 da Gilbert Stork . Dalla sintesi iniziale sono stati sviluppati diversi approcci alternativi.
La sintesi totale di Woodward inizia con la costruzione dell'anello E, che contiene cinque dei sei stereocentri della molecola di reserpina. I materiali di partenza sono 1,4-benzochinone e metil penta-2,4-dienoato. Una reazione di Diels-Alder si verifica tra il chinone e il diene , il cui prodotto contiene già tre dei cinque stereocentri richiesti a causa della conservazione della simmetria orbitale nelle reazioni concertate .
La riduzione dell'endoaddotto risultante con triisopropossido di alluminio è controllata tramite il collegamento cis dei due anelli risultanti in modo tale che, soprattutto, si formi il -alcol mostrato. Poiché uno dei due gruppi ossidrile è in prossimità del metilcarbossilato, si forma un lattone .
La reattività dei due doppi legami negli anelli è diversa rispetto agli elettrofili : quando il C 11 H 12 O 3 è bromurato , reagisce solo il doppio legame del successivo anello E, poiché è leggermente più ricco di elettronica.
Come risultato dell'attacco elettrofilo del bromo, lo ione bromonio si forma scindendo uno ione bromuro. L'ossigeno del gruppo ossidrile apre questo anello a tre membri per attacco nucleofilo all'atomo di carbonio che è spazialmente più favorevole, così che si forma un furano .
Nel seguito il bromo viene sostituito dall'attacco nucleofilo di uno ione metanolato , per cui si forma il primo dei numerosi esteri metilici della reserpina: dopo l'eliminazione del bromuro di idrogeno e la formazione del lattone α, -insaturo, viene attaccato dallo ione metanolato. L'attacco per metanolazione avviene per il lattone e l'etere dal lato α, cioè da sotto il piano del disegno, che crea il quinto stereocentro dell'anello E.
Segue la seconda bromurazione: la N-bromosuccinimide attacca elettrofilicamente il doppio legame, che non può essere rotto da Br 2 nella terza fase . Lo ione bromonio risultante viene aperto transdiassialmente dall'attacco nucleofilo dell'acqua dal lato α. L'acido solforico funge da catalizzatore per la reazione .
Il prodotto viene quindi ossidato con acido cromico o triossido di cromo .
Il passaggio successivo è una reazione complessa che comporta la rimozione dell'atomo di bromo, la rottura di due anelli e l'aggiunta di un residuo di acetato.
Il primo passo qui è una debrominazione radicale e riduttiva. Lo zinco aggiunto subisce prima un singolo trasferimento di elettroni nell'orbitale non occupato π * del legame C – Br, per cui quest'ultimo viene immediatamente dissolto con la formazione di uno ione bromuro. Si forma per breve tempo un radicale C secondario, elettrofilo, che riceve immediatamente un secondo elettrone dallo zinco e diventa un anione - mesomerico stabilizzato dal vicino gruppo carbonilico - che viene protonato dall'acido acetico . L'apertura del lattone procede analogamente dopo la precedente protonazione del gruppo lattone carbonilico sull'ossigeno (questo abbassa la densità elettronica e quindi la posizione energetica dell'orbitale π* del legame C – O da aprire).
Nella seconda fase, il gruppo carbossile risultante viene metilato con diazometano .
Nella terza fase, la base debole piridina estrae il protone dalla prima fase, creando un enolato . Nella quarta fase, questo reagisce immediatamente al chetone α-β-insaturo . Con l'atomo di ossigeno separato, l' anidride acetica forma un acetil estere con eliminazione di un anione acetato a quello che sarà poi C-18.
Successivamente, l'ultimo anello a D viene aperto. A tale scopo, il doppio legame viene prima cis- diidrossilato con tetrossido di osmio , si forma un glicole .
Il glicole viene quindi scisso ossidativamente utilizzando acido periodico , creando un'aldeide e una chetoaldeide . Quest'ultimo viene ulteriormente ossidato dall'acido periodico tramite un chetoacido e la sua decarbossilazione a gruppo carbossilico semplice.
Infine, il gruppo carbossilico viene metilato con diazometano, con il quale viene costruito l'E-ring.
L'aldeide viene ora condensata con la triptamina 6-metossitriptamina per formare un'aldimina , quindi si forma un doppio legame tra il carbonio del gruppo aldeidico e l'azoto del gruppo amminico con eliminazione dell'acqua.
L'aldimina viene poi ridotta con sodio boroidruro . Il prodotto ciclizza spontaneamente a lattame . Il pirrolo viene attaccato per reazione con l'ossicloruro di fosforo ( reazione di Bischler-Napieralski ), che chiude l'anello C con la formazione di uno ione iminio . Lo ione iminio viene quindi ridotto con sodio boroidruro.
A causa della struttura spaziale dell'edotto, tuttavia, l'anione idruro attacca da sotto il livello molecolare, dove è meno ostacolato. Inoltre, il prodotto termodinamicamente più stabile viene creato in questo modo, il che significa che la molecola formata è un epimero della reserpina, ma non ancora la reserpina stessa: in primo luogo, la configurazione dello stereocentro appena creato in C-3 deve essere invertita. Per fare ciò, i primi due esteri vengono scissi idroliticamente con idrossido di potassio , in modo che si formi un gruppo carbossilico in C-16 e un gruppo ossidrile in C-18 , da cui si forma un lattone con l'aiuto della dicicloesilcarbodiimmide (DCC ). Successivamente, le condizioni di stabilità sono cambiate sufficientemente che l'atomo di idrogeno in C-3 può essere spostato nella posizione ora più stabile con acido pivalico . Dopo che l'epimerizzazione è completa, il lattone viene nuovamente saponificato.

L'ultimo passaggio della sintesi totale secondo Woodward consiste nella esterificazione con 3,4,5-trimetossibenzoil cloruro di racemica (±) -reserpine. Gli enantiomeri vengono separati mediante formazione di sali con acido canforsolfonico e separazione dei canforsolfonati diastereomerici, per cui si può ottenere (-) - reserpina pura.
Nomi commerciali
Monopreparazione contro la schizofrenia: Sedaraupin (D), Serpasil (D)
Combinazione con
- Bendroflumetiazide : Tensionorms (F)
- Clopamid e Diidroergocristina : Normatens (PL)
fonti
Risorse principali
- Forth, Henschler, Rummel: farmacologia e tossicologia generale e speciale . Urban & Fischer, Monaco / Jena 2001, ISBN 3-437-42520-X , pp. 205-207. [Sezione # Meccanismo d'azione ]
- Stitzel: Il destino biologico della reserpina . In: Recensioni farmacologiche (1977), Vol. 28, pp. 179-205. [Sezione #Farmacocinetica ]
- Lüllmann, Mohr, Wehling: Farmacologia e Tossicologia . Thieme, Stoccarda 2003, ISBN 3-13-368515-5 , pp. 90-91, 545. [Sezione # Effetti collaterali e interazioni ]
- Rimpler: farmaci biogeni . Deutscher Apotheker Verlag, Stoccarda 1999, ISBN 3-7692-2413-2 , pp. 309-310. [Sezione #Biosintesi ]
- Habermehl, Hammann, Krebs: chimica dei prodotti naturali . Springer, Berlino 2002, ISBN 3-540-43952-8 , pp. 181-185. [Sezione #Sintesi totale ]
Evidenze individuali
- ↑ European Pharmacopoeia Commission (Ed.): EUROPEAN PHARMACOPOE 6TH EDITION . nastro 6.0-6.2 , 2008.
- ↑ a b Moffat, Osselton, Widdop, Galichet (a cura di): Clarke's Analysis of Drugs and Poisons . Pharmaceutical Press, Bath 2004, ISBN 0-85369-473-7 . SS. 1531-1532.
- ↑ Scheda tecnica della reserpina presso AlfaAesar, consultata il 19 febbraio 2010 ( PDF )(JavaScript richiesto) .
- ↑ a b c Scheda tecnica della reserpina presso Sigma-Aldrich , consultata l'8 maggio 2017 ( PDF ).
- ↑ Roth, Daunderer, Kormann: piante tossiche - veleni vegetali . Hüthig Jehle Rehm, 1994, ISBN 3-609-64810-4 , pagina 605.
- ↑ a b c Giebelmann, von Meyer: Kulturgeschichtliches zu Hundsgiftgewächsen (2003; PDF; 418 kB).
- ↑ Wink, van Wyk, Wink: Manuale di piante velenose e psicoattive . Wissenschaftliche Verlagsgesellschaft, Stoccarda 2008, ISBN 3-8047-2425-6 , pagina 200.
- ^ Polz: Biosintesi degli alcaloidi di Rauwolfia . Monaco, 1989. (Diss.) Ss. 1-6.
- ↑ Sen, Bose: Rauwolfia serpentina, un nuovo farmaco indiano per la pazzia e l'ipertensione . In: Indian Med World (1931), Vol. 2, pp. 194-201.
- ↑ a b Kline: Uso di Rauwolfia serpentina Benth in condizioni neuropsichiatriche . In: Annals of the New York Academy of Sciences (1954), Vol. 59, pp. 107-132.
- ↑ Vakil: effetti antipertensivi di Rauwolfia . In: British Health Journal 11, pp. 350-355.
- ↑ a b Langer: estratti da una storia degli psicofarmaci nel XX secolo . In: Langer, Heimann (Ed.): Psychopharmaka - Fondamenti e Terapia . Springer, Vienna 1983, ISBN 3-211-81746-8 . SS. 25-26.
- ^ Möller, Laux, Deister: Psichiatria e psicoterapia . Thieme, Stoccarda 2005, ISBN 3-13-128543-5 , pagina 492.
- ↑ Urs German: Test antidroga presso la clinica universitaria psichiatrica di Basilea 1953–1980 , studio pilota dell'Università di Berna, 9 marzo 2017.
- ↑ Wittern: la storia degli psicofarmaci prima dell'era dei moderni farmaci psicotropi . In: Langer, Heimann (Ed.): Psychopharmaka - Fondamenti e Terapia . Springer, Vienna 1983, ISBN 3-211-81746-8 , pagina 17.
- ↑ Freis: Depressione mentale in pazienti ipertesi trattati per lunghi periodi con grandi dosi di reserpina . In: New England Journal of Medicine , Vol. 251, pp. 1006-1008.
- ↑ a b Bebarta, Dart: Rauwolfia Alcaloids . In: Dart (a cura di): Tossicologia medica . Lippincott Raven, Filadelfia 2004, ISBN 0-7817-2845-2 , pagina 712.
- ↑ a b Woodward et al.: La sintesi totale della reserpina . In: Tetraedro (1958), Vol. 2, pp. 1-57.
- ↑ Hans Bangen: Storia della terapia farmacologica della schizofrenia. Berlino 1992, pagina 90 ISBN 3-927408-82-4 .
- ↑ Hans Bangen: Storia della terapia farmacologica della schizofrenia. Berlino 1992, pagina 90 ISBN 3-927408-82-4 .
- ↑ a b c Sreemantula, Boini, Nammi: metonitrato di reserpina, un nuovo analogo quaternario della reserpina aumenta l'escrezione urinaria di VMA e 5-HIAA senza influenzare l'HVA nei ratti . In: BMC Pharmacology (2004), Vol. 4. Testo integrale .
- ↑ Hans Bangen: Storia della terapia farmacologica della schizofrenia. Berlino 1992, ISBN 3-927408-82-4 . P. 90-95: Neurolettici e teorizzazione psichiatrica
- ↑ Approccio: farmaci antipertensivi . In: Schwabe, Paffrath: Rapporto sull'ordinanza sulla droga 2006 . Springer, Berlino 2006, ISBN 3-540-34369-5 , pp. 418-420. E in: Schwabe, Paffrath: Medicinal Prescription Report 2007 . Springer, Berlino 2007, ISBN 3-540-72547-4 , pp. 380-381.
- ↑ a b Strong: Farmacologia dei sistemi noradrenergici e adrenergici . In: Forth, Henschler, Rummel: Farmacologia e tossicologia generale e speciale . Urban & Fischer, Monaco / Jena 2001, ISBN 3-437-42520-X , pagina 206.
- ↑ a b Kähler: alcaloidi della Rauwolfia . Boehringer Mannheim, Mannheim, 1970. SS. 108-113.
- ↑ Porzig, Engelhardt: Prodotti farmaceutici con effetto sul sistema nervoso vegetativo. In Estler, Schmidt (a cura di): Farmacologia e tossicologia . Schattauer, Stoccarda, 2006, pagina 144.
- ↑ a b c d Porzig, Häusler: Prodotti farmaceutici con effetto sul sistema nervoso vegetativo . In: Estler (Ed.): Farmacologia e Tossicologia . Schattauer, Stoccarda/New York 2000, ISBN 3-7945-1898-5 , pagina 96.
- ↑ Hans Bangen: Storia della terapia farmacologica della schizofrenia. Berlino 1992, pagina 90 ISBN 3-927408-82-4 .
- ↑ Mutschler, Geisslinger, Kreemer, Ruth, Schäfer-Körting: Mutschler Drug Effects Compact . pag. 72.
- ↑ Heintze: prodotti farmaceutici con effetto sul tratto gastrointestinale . In: Estler (Ed.): Farmacologia e Tossicologia . Schattauer, Stoccarda/New York 2000, ISBN 3-7945-1898-5 , pagina 435.
- ↑ Verspohl: neurolettici . In: Ammon (Ed.): Lato farmacologico e interazioni farmacologiche . Wissenschaftliche Verlagsgesellschaft, Stoccarda 1991, ISBN 3-8047-1155-3 , pagina 255.
- ↑ Chen, Danon: Legame della reserpina all'albumina plasmatica e alle lipoproteine . In: Farmacologia Biochimica (1979), Vol. 28, pp. 267-271.
- ↑ a b Beyer: Biotransformation der Arzneimittel . Springer, Berlino/Heidelberg/New York 1990, ISBN 3-540-50696-9 , pp. 489-490.
- ^ Cohen: Reserpina . In: Sadée (Ed.): Monitoraggio del livello di droga . John Wiley & Sons, New York / Chichester / Brisbane / Toronto 1980, ISBN 0-471-04881-X , pp. 415-417.
- ↑ Hansel, Sticher: Pharmakognosie - Phytopharmazie . Springer, Heidelberg 2007, ISBN 3-540-26508-2 , pp. 1421-1424.
- ↑ a b c Mutschler, Geisslinger, Kroemer, Ruth, Schäfer-Korting: effetti della droga Mutschler . Wissenschaftliche Verlagsgesellschaft, Stoccarda 2008, ISBN 978-3-8047-1952-1 , pagina 357.
- ^ Wehling: Malattie cardiovascolari . In: Wehling (Ed.): Farmacologia Clinica . Thieme, Stoccarda 2005, ISBN 3-13-126821-2 .
- ↑ Commissione sui farmaci dell'Associazione medica tedesca (a cura di): Ordinanze sui farmaci: raccomandazioni per la farmacoterapia razionale . Deutscher Ärzte-Verlag, Colonia 2006, ISBN 3-7691-1201-6 , pagina 681.
- ^ Kähler: alcaloidi della Rauwolfia . Boehringer Mannheim, Mannheim, 1970. SS. 123-127.
- ^ Medicina del lessico di Roche: Reserpina dell'articolo . Urban & Fischer, Monaco di Baviera 2006, ISBN 3-437-15156-8 , pagina 1585.
- ↑ James PA, Oparil S, Carter BL, Cushman WC, Dennison-Himmelfarb C, Handler J, Lackland DT, LeFevre ML, MacKenzie TD, Ogedegbe O, Smith SC, Svetkey LP, Taler SJ, Townsend RR, Wright JT, Narva AS , Ortiz E: linea guida 2014 basata sull'evidenza per la gestione dell'ipertensione negli adulti: relazione dei membri del panel nominati all'ottavo comitato nazionale congiunto (JNC 8) . In: JAMA . 311, n. 5, febbraio 2014, pp. 507-20. doi : 10.1001 / jama.2013.284427 . PMID 24352797 .
- ↑ Shamon SD, Perez MI: Efficacia ipotensiva della reserpina per l'ipertensione primaria . In: Cochrane Database Syst Rev . 12 dicembre 2016, pagina CD007655. doi : 10.1002 / 14651858.CD007655.pub3 . PMID 27997978 . PMC 6464022 (testo completo gratuito).
- ↑ Risultati quinquennali del programma di rilevamento e follow-up dell'ipertensione. I. Riduzione della mortalità delle persone con ipertensione, compresa l'ipertensione lieve. Gruppo cooperativo di rilevamento e follow-up dell'ipertensione . In: JAMA . 242, n. 23, 1979, pp. 2562-71. doi : 10.1001 / jama.242.23.2562 . PMID 490882 . testo completo a OVID
- ^ Effetti del trattamento sulla morbilità nell'ipertensione. Risultati in pazienti con pressione sanguigna diastolica in media da 115 a 129 mm Hg . In: JAMA . 202, n. 11, 1967, pp. 1028-34. doi : 10.1001 / jama.202.11.1028 . PMID 4862069 .
- ^ Prevenzione dell'ictus mediante trattamento farmacologico antipertensivo nelle persone anziane con ipertensione sistolica isolata. Risultati finali dell'Ipertensione Sistolica nell'Anziano Programma (SHEP). Gruppo di ricerca cooperativa SHEP . In: JAMA . 265, n. 24, 1991, pp. 3255-64. doi : 10.1001 / jama.265.24.3255 . PMID 2046107 .
- ↑ ((ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group)): Principali risultati in pazienti ipertesi ad alto rischio randomizzati a inibitore dell'enzima di conversione dell'angiotensina o calcio-antagonista vs diuretico: il trattamento antiipertensivo e ipolipemizzante per prevenire l'infarto (ALLHAT) Archiviato dall'originale il 26 novembre 2009. In: JAMA . 288, n. 23, 18 dicembre 2002, pp. 2981-97. doi : 10.1001 / jama.288.23.2981 . PMID 12479763 .
- ^ Shen, Howard: Schede di memoria illustrate di farmacologia: farmacologia . Minireview, 2008, ISBN 978-1-59541-101-3 , pagina 11.
- ↑ Bhomraj Thanvi, Nelson Lo e Tom Robinson: Discinesia indotta da Levodopa nella malattia di Parkinson: caratteristiche cliniche, patogenesi, prevenzione e trattamento Postgrad Med J. 2007 Jun; 83 (980): 384-388. PMC 2600052 (testo completo gratuito).
- ^ Forney B. Reserpine per uso veterinario. Disponibile su http://www.wedgewoodpetrx.com/learning-center/professional-monographs/reserpine-for-veterinary-use.html .
- ↑ Parai D, Banerjee M, Dey P, Mukherjee SK: la reserpina attenua la formazione di biofilm e la virulenza di Staphylococcus aureus . In: Microb. Pathog. . 138, ottobre 2019, pagina 103790. doi : 10.1016 / j.micpath.2019.103790 . PMID 31605761 .
- ↑ Bopp, Herbst: Medicines Handbook . Stiftung Warentest , 2010, ISBN 978-3-86851-119-2 .
- ↑ Willner: meccanismi dopaminergici nella depressione e nella mania . In: Psicofarmacologia: la quarta generazione del progresso; Raven Press, Ltd., New York, pagina 925.
- ↑ Goodwin, Ebert, Bunney: effetti mentali della reserpina nell'uomo: una recensione . In: Shader: Complicanze psichiatriche dei farmaci . New York, Raven Press, 1972, pp. 73-101.
- ↑ Mutschler, Geisslinger, Kroemer, Ruth, Schäfer-Korting: effetti della droga Mutschler . Wissenschaftliche Verlagsgesellschaft, Stoccarda 2008, ISBN 978-3-8047-1952-1 , pagina 1085.
- ↑ Kretzschmar, Stille: Farmaci psicotropi . In: Estler (Ed.): Farmacologia e Tossicologia . Schattauer, Stoccarda/New York 2000, ISBN 3-7945-1898-5 , pagina 237.
- ↑ Verspohl: neurolettici . In: Ammon (Ed.): Lato farmacologico e interazioni farmacologiche . Wissenschaftliche Verlagsgesellschaft, Stoccarda 1991, ISBN 3-8047-1155-3 , pp. 279-280. E: In breve: sostanze antiipertensive . In: ibid. SS. 671-672.
- ↑ a b c Eger, Troschütz, Roth: analisi dei farmaci . Deutscher Apotheker Verlag, Stoccarda 1999, ISBN 3-7692-2595-3 , pp. 527-531.
- ↑ Auterhoff , Knabe, Höltje: libro di testo di chimica farmaceutica . Wissenschaftliche Verlagsgesellschaft, Stoccarda 1994, ISBN 3-8047-1356-4 .
- ↑ a b Chen, Huan: Reserpina: una sfida per la sintesi totale di prodotti naturali . In: Recensioni chimiche, Vol. 105, pp. 4671-4706; doi: 10.1021/cr050521a .
- ↑ Cicogna: la sintesi stereospecifica della reserpina . In: Pure Applied Chemistry (1989), Vol. 61, pp. 439-442. Vedi anche: Punti salienti della chimica organizzativa
- ↑ Joelle Gauchet: A Comparative Analysis ot the Syntheses of Reserpine ( Memento from 14 luglio 2010 in Internet Archive ), 1992 (varianti di sintesi in un confronto schematico / inglese, pdf; 665 kB)
- ↑ Riferimenti ad alcune opere originali ( Memento del 31 marzo 2010 in Internet Archive ) (lì dal n. 21; PDF; 86 kB)













