flavonoidi
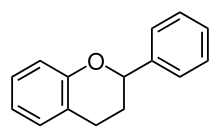
I flavonoidi sono un gruppo di sostanze naturali , a cui appartiene gran parte dei pigmenti dei fiori. I flavonoidi appartengono al gruppo dei polifenoli . Sono formalmente derivati dal corpo di base Flavan (2-fenilcroman): due anelli aromatici che sono collegati da un anello tetraidropiranico . In natura esistono circa 8000 composti, la cui diversità è creata da diversi stati di ossidazione nell'anello contenente ossigeno, diverse sostituzioni sugli anelli aromatici e l'aggiunta di zuccheri ( formazione di glicosidi ). La biosintesi avviene attraverso la via dell'acido shikimico .
I flavonoidi sono universalmente presenti nelle piante come sostanze vegetali secondarie , quindi anche nell'alimentazione umana. Si dice che abbiano proprietà particolarmente antiossidanti . Un certo numero di piante contenenti flavonoidi sono utilizzate in medicina.
I flavonoidi furono scoperti negli anni '30 dal premio Nobel Albert von Szent-Györgyi Nagyrápolt e inizialmente indicati come vitamina P. La "P" della vitamina P sta per " fattore di permeabilità ".
Cognome
Alcune piante come la Quercia tintoria ( Quercus tinctoria ), l' Erba della tintoria ( Reseda luteola ) o il Gelso tintore ( Maclura tinctoria ) venivano utilizzate in passato per l'ingiallimento. Dopo aver identificato i loro ingredienti, questo gruppo di coloranti è stato chiamato flavoni, dai latini parola flavus per giallo. Quando è stato riconosciuto che molti degli ingredienti sono strutturati allo stesso modo, ma hanno un colore diverso o sono incolori, il gruppo di sostanze è stato chiamato flavonoidi.
Evento
I flavonoidi sono universali nel regno vegetale e si trovano nelle piante da seme così come nei muschi e nelle felci . La formazione di flavonoidi è nota solo da parte di pochi microrganismi, come la muffa dell'annaffiatoio Aspergillus candidus . Gli animali non possono produrre flavonoidi. La presenza in alcune specie animali, ad esempio nelle ali di alcune farfalle , è dovuta all'ingestione di flavonoidi vegetali con il cibo e al loro accumulo nell'organismo. Secondo altre fonti, i flavonoidi sono limitati alle piante.
Struttura, diversità e sottogruppi
La struttura di base dei flavonoidi è costituito da due anelli aromatici che sono collegati da un gruppo C 3 ponte. L'anello A mostra principalmente il pattern di sostituzione della floroglucina , che indica la sua origine nel metabolismo dei polichetidi . L'anello B e il ponte C 3 hanno origine dalla via dell'acido shikimico , l'anello B è per lo più idrossilato a 4', spesso anche a 3' o 3' e 5'. Nella stragrande maggioranza dei flavonoidi (con l'eccezione dei calconi ) il ponte C 3 è chiuso per formare un anello O-eterociclico (anello C). La struttura di base dei flavonoidi è quindi il flavan (2-fenilcromano). L'anello B è raramente spostato nella posizione 3 (isoflavano, derivato dagli isoflavoni ) o 4 (neoflavano).
Sono già stati descritti un totale di oltre 8000 diversi flavonoidi (al 2006). Il disegno, in particolare il grado di ossidazione al C 3 ponte, serve a suddividere i flavonoidi nei vari sottogruppi.
Sei grandi sottogruppi si trovano nella maggior parte delle piante superiori: calconi , flavoni , Flavonoli , Flavandiols , Antociani, e abbreviato Tannini . Gli uroni sono molto comuni, ma non onnipresenti. Gli isoflavoni (soprattutto nelle Fabaceae ) e le 3-desossi-antocianidine, che si formano come precursori dei flobafeni, ad esempio da Vitis vinifera , Arachis hypogaea e Pinus sylvestris , sono ristretti a pochi gruppi .
La diversità strutturale dei flavonoidi è dovuta al gran numero di schemi di sostituzione sugli anelli A e B, nonché al fatto che i flavonoidi di solito non sono liberi, ma piuttosto come glicosidi . Sono stati identificati oltre 80 zuccheri diversi. Per la quercetina sono stati descritti 179 diversi glicosidi.
| Sottogruppo | Struttura basilare | Esempi |
|---|---|---|
| Flavanoli |

|
Catechina , gallocatechina , epicatechina , epigallocatechina gallato |
| Flavanoli |

|
Taxifolina |
| Calconi |

|
Isoliquiritigenina , xantumolo (R2 = OH) |
| Antociani ( Antociani ) ("Flavenoli") |

|
Cianidina , delfinidina , malvidina , pelargonidina , peonidina , petunidina (R3 = OH) |
| Flavonoli |

|
Morin , quercetina ( glicoside rutina e metil etere isorhamnetina ), kaempferol , miricetina , fisetina |
| Aurone |

|
Aureusidin |
| Flavoni |

|
Luteolina , apigenina |
| Flavanoni |

|
Esperetina , naringenina , eriodictyol |
| isoflavoni |

|
La genisteina , daidzeina , Licoricidin |
biosintesi
Il punto di partenza per la biosintesi dei flavonoidi è l'aminoacido aromatico fenilalanina , che si forma attraverso la via dell'acido shikimico . La fenilalanina viene convertito in trans - acido cinnamico dal liasi fenilalanina ammoniaca (PAL) . Questo a sua volta viene idrossilato ad acido p- umarico dalla 4- idrossilasi dell'acido cinnamico . Questo percorso è comune a tutti i fenilpropanoidi . L' acido p- cumarico viene attivato per formare cumaril-coenzima A.
Nella fase successiva del secondo anello aromatico si forma: l'enzima calcone sintasi (CHS) si forma dal cinnamoil-CoA e tre molecole di malonil-coenzima A , costituite dalla sintesi degli acidi grassi originano il calcone . Il calcone è in equilibrio con il flavanone per l'azione della calcone isomerasi (CHI). Questo chiude il terzo anello.
I tre enzimi chiave (PAL, CHS e CHI) e in parte gli enzimi delle ulteriori fasi di sintesi sono presenti come complessi enzimatici . Il complesso è probabilmente localizzato sul lato citosolico del reticolo endoplasmatico .
I vari percorsi portano dal flavanone ai flavoni, flavonoli, isoflavoni e antocianidine.
La biosintesi dei flavonoidi è indotta dalla luce, lo stoccaggio avviene principalmente nel vacuolo .
La maggior parte degli enzimi per la biosintesi dei flavonoidi proviene da tre classi di enzimi presenti in tutti gli organismi: diossigenasi dipendenti dall'ossoglutarato, reduttasi dipendenti dal NADPH e idrossilasi del citocromo P450. I due enzimi chiave CHS e CHI appartengono a famiglie diverse. È probabile che il CHI sia unico per le piante in termini sia di sequenza che di struttura tridimensionale. CHS, a sua volta, appartiene alla superfamiglia dei polichetidi sintasi vegetali .
significato
I vari flavonoidi svolgono una moltitudine di funzioni nelle piante.

I flavonoidi costituiscono il gruppo più importante tra i pigmenti dei fiori e servono ad attirare gli impollinatori . Gli antociani forniscono una varietà di colori che vanno dall'arancione al rosso al blu. Tutti i fiori contenenti antociani contengono anche flavoni e/o flavonoli, che servono a stabilizzare gli antociani, ma in concentrazioni più elevate fanno anche spostare il colore dei fiori nella zona blu. Il colore dei fiori gialli è meno spesso causato dai flavonoidi. I flavonoidi come la gossypetina e la quercetagetina sono responsabili del colore giallo dei fiori di Gossypium hirsutum , Primula vulgaris e alcune piante di girasole come Chrysanthemum segetum . Calconi e auroni sono responsabili del colore dei fiori gialli in alcune altre piante di margherite come Coreopsis e Dahlia e in altre nove famiglie di piante. I flavonoidi gialli si trovano spesso nella famiglia delle margherite insieme ai carotenoidi gialli . Il 95% del colore dei fiori bianchi è causato dai flavonoidi: flavoni come luteolina e apigenina e flavonoli come kaempferol e quercetina , con i flavonoli che assorbono un po' di più nella gamma delle onde lunghe.
I tannini condensati interagiscono con le glicoproteine presenti nella saliva degli erbivori e hanno un effetto astringente . Riducono la digeribilità delle piante e quindi scoraggiano molti potenziali erbivori.
Altri flavonoidi agiscono come protezione contro gli erbivori ( repellenti ). Per gli insetti specializzati, tali flavonoidi sono a loro volta stimolanti dell'alimentazione. In particolare, i glicosidi flavonici e flavonolici, ad esempio a base di rutina , quercitrina e isoquercitrina , sono tossici per gli insetti, mentre sono atossici per gli animali superiori. La crescita dei vari bruchi si riduce drasticamente in presenza, ad esempio, di isoquercitrina nella dieta, al 10% dei gruppi di controllo. Questi flavonoidi si trovano principalmente nelle piante erbacee e dovrebbero sostituire i tannini condensati delle piante legnose.
I flavoni e i flavonoli in particolare agiscono come protezione contro i raggi UV e la luce a onde corte. Si depositano sotto forma libera di piante in luoghi estremi come nelle zone aride o alpine sulla superficie fogliare, spesso sotto forma di rivestimenti simili a farina. In questo modo si previene la distruzione foto-ossidativa delle membrane e dei pigmenti fotosintetici . Grazie alla loro lipofilia , riducono anche la colonizzazione della superficie fogliare da parte di microrganismi . I flavonoidi hanno anche effetti antivirali , antibatterici e antimicotici diretti .
Alcuni flavonoidi vegetali svolgono un ruolo nella regolazione della espressione genica nel batterio noduli Rhizobium .
I flavonoidi altamente metossilati si trovano spesso negli essudati delle gemme e di altre secrezioni lipofile . Hanno un effetto fungicida , così come la nobiletina nelle foglie di agrumi .
I flavonoidi agiscono come strutturale tema nello sviluppo selettivo GABA A recettore - legante .
Flavonoidi negli alimenti e nelle medicine
cibo
Gli esseri umani assumono maggiori quantità di flavonoidi con il cibo. Circa due terzi delle sostanze fenoliche di circa un grammo che gli esseri umani consumano ogni giorno sono flavonoidi. Il gruppo principale sono i flavanoli (soprattutto nei paesi con consumo di tè). Per molto tempo si è ipotizzato che l'effetto potenziale dei flavonoidi si basi sui loro effetti antiossidanti, ma questo è sempre più dubbio e altre modalità d'azione sono più probabili.
Gli studi epidemiologici hanno mostrato un minor rischio di varie malattie con una maggiore assunzione di flavonoidi, inclusa la mortalità per malattie cardiovascolari . I flavonoidi agiscono sul metabolismo dell'acido arachidonico e quindi sulla coagulazione del sangue. Vari studi (dal 2016) mostrano che i flavonoidi sono anche direttamente efficaci contro il cancro o il suo sviluppo.
Alcuni composti hanno dimostrato di essere mutageni o genotossici nei test in vitro . Si sospetta che gli estratti di tè verde siano dannosi per il fegato . Un effetto collaterale di un farmaco a base di (+)-catechina che da allora è stato ritirato dal mercato è stata l'anemia emolitica . Inoltre, si sospetta che i flavonoidi portino alla chiusura prematura del dotto arterioso .
Alcuni flavonoidi determinano una forte inibizione delle monoossigenasi dipendenti dal citocromo P450 (enzimi di fase I), altri a loro volta determinano un'attivazione. Può anche verificarsi un'attivazione dose-dipendente degli enzimi di fase II . Tutto ciò può portare a interazioni farmacologiche, come il pompelmo .
Importanza farmaceutica
A scopo terapeutico vengono utilizzati numerosi medicinali contenenti flavonoidi , nonché alcune sostanze pure. Sono usati come agenti venosi per il loro effetto protettivo vascolare, antiedematoso, come agenti cardiovascolari per il loro positivo effetto inotropo , antipertensivo , come diuretici , come spasmolitici per disturbi gastrointestinali e come terapeutici del fegato. Il suo effetto è principalmente attribuito alle sue proprietà antiossidanti e all'inibizione degli enzimi .
Gli studi epidemiologici e la maggior parte in vivo indicano che i flavonoidi hanno un'influenza positiva su varie malattie cardiovascolari . Tradizionalmente, questi effetti sono stati attribuiti solo alle loro attività antiossidanti . Tuttavia, oltre al legame diretto delle specie reattive dell'ossigeno (ROS), ci sono una serie di altri effetti che, in concentrazioni farmacologicamente ottenibili, hanno anche un effetto positivo sull'influenza cardiovascolare dei flavonoidi come ad es. B. Taxifolin potrebbe essere responsabile. Questi includono, in particolare, l'inibizione degli enzimi che formano ROS, l'inibizione della funzione piastrinica , l'inibizione dell'attivazione dei leucociti e le proprietà vasodilatatrici.
Tra i numerosi effetti dei flavonoidi che sono stati dimostrati nei test in vitro e in vivo , i più importanti sono:
- effetto antiallergico e antinfiammatorio
- effetti antivirali e antimicrobici
- effetto antiossidante
- anti-proliferativa e anti- cancerogeni effetti
I flavonoidi agiscono attraverso diversi meccanismi d'azione. Il focus è sull'interazione con il DNA e gli enzimi, l'attivazione delle cellule, la loro proprietà come radical scavenger e l'influenza di varie vie di trasduzione del segnale nelle cellule ( NF-κB , MAPK ). I flavonoidi inibiscono oltre trenta enzimi nel corpo umano. Attivano un'ampia varietà di tipi di cellule nel sistema immunitario . Le ultime due proprietà sono responsabili degli effetti antinfiammatori dei flavonoidi.
I seguenti flavonoidi sono usati come sostanze pure come agenti venosi:
Tra i farmaci predominano quelli che contengono glicosidi flavonoli e glicosilflavoni. Importanti farmaci medicinali che contengono grandi quantità di flavonoidi sono:
- Fiori di arnica ( arnica )
- Foglie di betulla ( betulla d'argento , betulla di palude )
- Erba di grano saraceno ( Fagopyrum esculentum )
- foglie di ginkgo ( ginkgo )
- Verga d' oro (da Solidago virgaurea , Solidago gigantea e Solidago canadensis )
- Sambuco ( sambuco nero )
- Coni di luppolo ( luppoli veri )
- Fiori di camomilla ( camomilla )
- Fiori di zampa di gatto (zampa di gatto comune )
- Estratto di larice ( Taxifolin )
- Erbe e fiori di olmaria ( olmaria )
- Frutti di cardo mariano ( cardo mariano )
- Erba della passiflora (da Passiflora incarnata )
- Scorza di arancia amara (arancia amara )
- Fiori di calendula ( calendula )
- camomilla romana
- Foglie di vite rossa ( Vitis vinifera )
- Fiori di cartamo ( cartamo )
- Viola del pensiero ( Viola arvense e Viola tricolore )
- Radice di liquirizia ( liquirizia )
- Foglie di biancospino con fiori (diverse specie di biancospino )
letteratura
- O. M. Andersen, KR Markham: Flavonoidi: chimica, biochimica e applicazioni . CRC Press, Taylor e Francis, Boca Raton 2006, ISBN 978-0-8493-2021-7 .
Evidenze individuali
- ↑ St. Rusznyak, Albert Szent-Györgyi: Vitamina P: flavonoli come vitamine. In: Natura. Volume 138, 1936, pagina 27.
- ↑ a b c d e f g h i j k Rudolf Hänsel , Otto Sticher (Ed.): Pharmakognosie. Fitofarmacia . 9a edizione. Springer Medizin Verlag, Heidelberg 2009, ISBN 978-3-642-00962-4 , pp. 1098-1152.
- ↑ a b c d e f Martin Luckner: metabolismo secondario in microrganismi, piante e animali . 3a edizione, VEB Gustav Fischer Verlag, Jena 1990, ISBN 3-334-00322-1 , pp. 406-415.
- ↑ a b c Brenda Winkel-Shirley: Biosintesi dei flavonoidi. Un modello colorato per genetica, biochimica, biologia cellulare e biotecnologia . In: Fisiologia vegetale. Volume 126, 2001, pp. 485-493, doi: 10.1104 / pp.126.2.485 .
- ↑ a b c d Bernhard Watzl, Gerhard Rechkemmer: Conoscenze di base aggiornate: Flavonoide. In: Recensione nutrizionale. Volume 48, n. 12, 2001 ( ernaehrungs-umschau.de ).
- ↑ a b c Hans-Walter Heldt : Biochimica vegetale . Spektrum Akademischer Verlag, Heidelberg 1996, ISBN 3-8274-0103-8 , pp. 423-437.
- ↑ Dieter Schlee: Biochimica ecologica . 2a edizione. Gustav Fischer Verlag, Jena 1992, ISBN 3-334-60393-8 , pagina 67 s.
- ↑ a b J. B. Harborne: Introduzione alla biochimica ecologica . Terza edizione. Academic Press, Londra 1988, ISBN 0-12-324684-9 , pp. 47-53.
- ^ JB Harborne: Introduzione alla biochimica ecologica . Terza edizione. Academic Press, Londra 1988, ISBN 0-12-324684-9 , pp. 95, 175 f.
- ↑ Joseph Naghski, Michael J. Copley, James F. Couch: L'azione antibatterica dei flavonoli. In: Giornale di batteriologia. Vol. 54, 34 (1947).
- ↑ Dieter Schlee: Biochimica ecologica . 2a edizione. Gustav Fischer Verlag, Jena 1992, ISBN 3-334-60393-8 , pagina 271 s.
- ↑ JR Hanrahan, M. Chebib, GA Johnston: modulazione dei flavonoidi dei recettori GABA (A) . In: Br J Pharmacol . 163, n. 2, 2011, pp. 234-245. doi : 10.1111 / j.1476-5381.2011.01228.x . PMID 21244373 . PMC 3087128 (testo completo gratuito).
- ↑ a b c Anna Vogiatzoglou, Angela A. Mulligan, Marleen AH Lentjes, Robert N. Luben, Jeremy PE Spencer: assunzione di flavonoidi negli adulti europei (da 18 a 64 anni) . In: PLOS UNO . nastro 10 , nr. 5 , 26 maggio 2015, pag. e0128132 , doi : 10.1371 / journal.pone.0128132 ( plos.org [consultato il 15 agosto 2017]).
- ↑ Robert J. Williams, Jeremy PE Spencer, Catherine Rice-Evans: Flavonoidi: antiossidanti o molecole di segnalazione? In: Biologia e medicina dei radicali liberi . nastro 36 , n. 7 , pag. 838–849 , doi : 10.1016 / j.freeradbiomed.2004.01.001 ( elsevier.com [consultato il 15 agosto 2017]).
- ↑ Anja Klappan: Influenza della quercetina flavonoide sulla via di segnalazione mTOR delle cellule del cancro cervicale e mammario . Monaco 2014, DNB 1048361322 , urn : nbn: de: bvb: 19-165609 (tesi, LMU Munich).
- ↑ Vedi anche José Rueff et al.: Tossicologia genetica dei flavonoidi: il ruolo delle condizioni metaboliche nell'induzione della mutazione inversa, funzioni SOS e scambi tra cromatidi. In: Mutagenesi. Volume 1, n. 3, 1986, pp. 179-183.
- ↑ Stephanie E. Martinez, Neal M. Davies, Jonathan K. Reynolds: tossicologia e sicurezza dei flavonoidi . In: FARMACOCINETICA FLAVONOIDI . John Wiley & Sons, Inc., 2012, ISBN 978-1-118-46852-4 , pp. 249-280 , doi : 10.1002 / 9781118468524.ch6 .
- ↑ D. Shinkov, I. Urumov, N. Doĭchinova, V. Manolova, R. Ananieva: [Anemia emolitica immunitaria causata da catergen] . In: Vutreshni Bolesti . nastro 28 , n. 5 , 1989, pp. 84-87 , PMID 2618015 .
- ↑ Paulo Zielinsky, Stefano Busato: Effetti prenatali del consumo materno di alimenti ricchi di polifenoli nella tarda gravidanza sul dotto arterioso fetale . In: Ricerca sui difetti di nascita Parte C: Embrione oggi: Recensioni . nastro 99 , n. 4 , 1 dicembre 2013, pag. 256-274 , doi : 10.1002/bdrc.21051 .
- ↑ P. Mladenka, L. Zatloukalová, T. Filipský, R. Hrdina: Gli effetti cardiovascolari dei flavonoidi non sono solo causati dall'attività antiossidante diretta . In: Biol Med di radicali liberi . 2010, 49, pp. 963-975, PMID 20542108 .