Legame peptidico

Un legame peptidico è un'ammide di acido carbossilico - legame , i due amminoacidi sul gruppo carbossilico di un amminoacido e il gruppo amminico legato al altro amminoacido.
Nella maggior parte dei casi, il legame peptidico in senso stretto indica il legame tra i rispettivi gruppi funzionali α di due amminoacidi, cioè tra C-1 di un amminoacido e N-2 dell'altro amminoacido. Questo legame è raramente chiamato anche legame eupeptidico ed è diverso dal legame isopeptidico .
meccanismo
Il legame è creato da una reazione di condensazione con eliminazione dell'acqua . Un esempio è la reazione di due molecole dell'amminoacido alanina per formare il dipeptide alanil-alanina :
Il gruppo amminico agisce come un nucleofilo nella reazione e sostituisce il gruppo idrossile per formare il legame peptidico. Poiché il gruppo idrossile è un cattivo gruppo uscente ed è difficile da spostare, l'equilibrio in condizioni normali è a sinistra. La reazione chimica è endergonica .
Sia nella sintesi peptidica in laboratorio che nella sintesi biologica di peptidi e proteine , i gruppi reattivi devono prima essere attivati. Nei sistemi biologici questo viene fatto principalmente dagli enzimi . Nella biosintesi delle proteine in una cellula , questa reazione è catalizzata dai ribosomi durante la traduzione . Inoltre, in alcuni organismi sono presenti anche sintetasi peptidiche non ribosomiali (NRPS) come enzimi che consentono la sintesi del peptide non ribosomiale .
Ulteriori amminoacidi (AA) possono essere collegati tramite legami peptidici mediante condensazione multipla. I dipeptidi (2 AA) danno luogo a tripeptidi (3), tetrapeptidi (4), pentapeptidi (5), esapeptidi (6), eptapeptidi (7), octapeptidi (8), nonapeptidi (9), ecc., Con tali peptidi da alcuni aminoacidi, chiamati oligopeptidi , possono essere distinti da peptidi ancora più grandi costituiti da molti aminoacidi, chiamati polipeptidi . Alle macromolecole appartengono i polipeptidi a catena costituiti da numerosi amminoacidi .
Le catene polipeptidiche di diversi amminoacidi formano l' elemento strutturale primario delle proteine e sono caratterizzate dalla loro sequenza amminoacidica . Per informazioni sulle strutture primarie, secondarie e terziarie di peptidi e proteine, vedere struttura delle proteine .
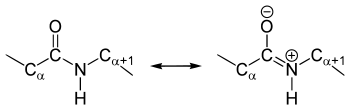
caratteristiche
Le analisi della struttura cristallina di amminoacidi e dipeptidi mostrano che il gruppo ammidico è planare , quindi tutti gli atomi coinvolti nella struttura si trovano su un piano. L' angolo diedro (HNCO) è di 180 ° e gli atomi non possono essere ruotati l'uno contro l'altro a causa della stabilizzazione del mesomerismo - il legame peptidico è quindi flessibile solo in modo rotazionale in misura limitata. Questa rotazione limitata può essere rappresentata in un diagramma di Ramachandran o in un diagramma di Janin . La rotazione attorno al legame C α -N è descritta dall'angolo Φ, la rotazione attorno al legame C α -C dall'angolo ψ.
Nelle proteine native sono presenti prevalentemente legami peptidici trans , i legami peptidici cis si trovano principalmente nei dipeptidi ciclici ( dichetopiperazine ) e tripeptidi ciclici (esempio: ciclotriprolile). La ragione per la frequente comparsa di trans -Peptidbindungen sono l' ingombro sterico tra i gruppi al α-C-atomo in cis -Peptidbindungen che in trans - configurazione non si verifica.
Le lunghezze di legame tra azoto e carbonile - carbonio 133 pm , tra azoto e atomo α-C 146 pm, tra carbonio carbonile e atomo α-C 151 pm e tra carbonio carbonile e ossigeno 124 pm. La lunghezza più breve del legame CN nel legame ammidico rispetto al normale legame CN indica che ha il carattere di un doppio legame ; questo tipo di legame chimico è anche chiamato doppio legame parziale. Questa particolarità è spiegata dalla tautomeria ammide-iminolo del legame peptidico.
Peptidi e ammidi

La reazione del gruppo carbossilico di un amminoacido e del gruppo amminico di un secondo amminoacido forma un legame peptidico con l'eliminazione dell'acqua. Ogni legame peptidico è anche un legame ammidico .
Un prerequisito per la formazione di un legame peptidico è la reazione di condensazione del gruppo carbossilico terminale sull'atomo di C 1 con il gruppo amminico sull'atomo α-C di un secondo amminoacido. Qualsiasi altra condensazione tra il gruppo carbossilico e il gruppo amminico porta anche a un legame ammidico, che non è, tuttavia, un legame peptidico.
Se i peptidi vengono allungati mediante legami peptidici, i gruppi carbossi o ammino terminali sull'atomo α-C reagiscono con ulteriori amminoacidi.
Prove individuali
- ↑ a b Commissione congiunta IUPAC-IUB sulla nomenclatura biochimica (JCBN). Nomenclatura e simbolismo per amminoacidi e peptidi. Raccomandazioni 1983 . In: European Journal of Biochemistry . nastro 138 , n. 1 , 2 gennaio 1984, ISSN 0014-2956 , pagg. 9-37 , doi : 10.1111 / j.1432-1033.1984.tb07877.x , PMID 6692818 ( nih.gov [visitato il 16 febbraio 2021]).
- ↑ a b Michael M. Cox, Albert L. Lehninger: Lehninger Biochemie con 131 tabelle . 4 °, completamente revisionato e exp. Edizione Berlino 2009, ISBN 978-3-540-68637-8 , pp. 109 .
- ^ Donald Voet, Judith G. Voet, Charlotte W. Pratt: Textbook of Biochemistry . Ed.: Annette G. Beck-Sickinger, Ulrich Hahn. 2a edizione. WILEY-VCH, 2016, ISBN 978-3-527-32667-9 , pagg. 146 .
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminoacidi, peptidi, proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2 .
- ↑ Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Stryer Biochemistry . Springer-Verlag, Berlino, Heidelberg 2015, ISBN 978-3-8274-2989-6 , pagg. 37 ( anteprima limitata nella ricerca di Google Libri).
- ↑ a b Hans-Dieter Jakubke, Hans Jeschkeit: Aminoacidi, peptidi, proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2 , pagg. 96-97.




