Spettroscopia UV / VIS
L' UV / VIS spettroscopia è un ottico spettroscopia molecolare appartenenza metodo spettroscopico , le onde elettromagnetiche del ultravioletta (UV) e visibile ( inglese visibile , VIS) chiara di utilizzati. Il metodo è anche noto come spettrofotometria UV / VIS o spettroscopia di assorbimento di elettroni . Nella vita di tutti i giorni, i dispositivi utilizzati sono spesso indicati in modo impreciso come fotometri .

principio
L'assorbimento della luce nell'intervallo delle radiazioni visibili e ultraviolette è causato dalle transizioni di elettroni tra i diversi stati della molecola . Durante queste transizioni, gli elettroni di valenza (ad esempio quelli degli orbitali pe d dei gusci esterni) vengono eccitati, cioè portati a un livello di energia più alto.
Ad esempio , per elevare un elettrone da un occupato ( HOMO ) a un orbitale più alto non occupato ( LUMO ), l'energia del fotone assorbito deve corrispondere esattamente alla differenza di energia tra i due livelli di energia. Sul contesto
- Δ
, la lunghezza d' onda della luce assorbita è calcolata per l'energia spesa, l' energia , la costante di Planck , la velocità della luce , la frequenza e la lunghezza d'onda sono dell'onda elettromagnetica. Questa relazione viene talvolta definita equazione di Einstein-Bohr. Questa relazione può essere rappresentata approssimativamente in forma semplificata sotto forma di un'equazione delle dimensioni su misura :
Le sostanze che assorbono solo nella gamma UV ( <400 nm) appaiono incolori all'occhio umano. Una sostanza è chiamata colorata se assorbe la radiazione nell'intervallo dello spettro visibile . Questo è prevedibile sia con composti che hanno basse energie di eccitazione ( transizioni da π a π * , sistemi di elettroni π coniugati come nel caso dei polieni ) sia con complessi di ioni inorganici con livelli di elettroni riempiti in modo incompleto (esempio: Cu 2 + - Connessioni (principalmente bluastre - verdastre) rispetto a composti Cu + incolori ). Le connessioni appaiono anche colorate quando esistono interazioni fortemente polarizzanti tra particelle vicine, come nel caso ad es. B. è il caso di giallo AgI . Se è presente una sola area di assorbimento, l'occhio percepisce il colore complementare alla radiazione assorbita .
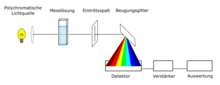
Fondamentalmente, i fenomeni di assorbimento delle radiazioni vengono valutati principalmente nel contesto della spettroscopia UV / VIS. Nella sua struttura di base, una sorgente luminosa emette radiazione elettromagnetica, che viene guidata attraverso il campione / analita tramite un percorso del raggio con specchi e altri componenti (dettagli di seguito) e quindi colpisce un rivelatore. Eccitando gli elettroni nel campione, l'intensità della radiazione viene indebolita rispetto al fascio primario originale nelle aree corrispondenti. Questa differenza nell'intensità della radiazione viene tracciata rispetto alla rispettiva lunghezza d'onda alla quale è stata effettuata la misurazione ed emessa come spettro .
Costruzione di uno spettrometro UV / Vis a due raggi
La sorgente luminosa emette luce ultravioletta, visibile e nel vicino infrarosso nella gamma di lunghezze d'onda da circa 200 nm a 1100 nm. La lunghezza d'onda selezionata per la misurazione viene prima selezionata nel monocromatore , dopodiché il raggio di luce cade sullo specchio settoriale. Lo specchio settoriale lascia passare la luce alternativamente attraverso la soluzione di misura e attraverso la soluzione di confronto. Entrambe le soluzioni sono nelle cosiddette cuvette . I due raggi di luce vengono ricevuti nel rivelatore e le intensità vengono confrontate nell'amplificatore. L'amplificatore regola quindi l'intensità del raggio di luce dalla soluzione di confronto all'intensità del raggio di luce dalla soluzione di misurazione ritirando il diaframma a pettine. Questo movimento viene trasferito a un registratore oppure i valori misurati vengono trasmessi a un elaboratore di dati.
Gli spettrometri UV / VIS senza cellule vengono sempre più utilizzati per determinare la concentrazione di piccoli volumi di campione (meno di 2 microlitri) di campioni con concentrazioni più elevate. I cosiddetti nanofotometri lavorano con spessori di strato che vanno da 0,04 mm a 2 mm. Non sono necessarie cuvette, né diluizioni e si possono analizzare campioni con un volume di soli 0,3 µl (con lo spessore minimo dello strato), ma hanno un limite di rilevamento più elevato a causa dello spessore ridotto dello strato . Una tecnica collaudata si basa su una compressione del campione, che è quindi indipendente dalla tensione superficiale e dall'evaporazione del campione. Questo metodo viene utilizzato per l'analisi di acidi nucleici (DNA, RNA, oligonucleotidi) e proteine (assorbimento UV a 280 nm). Secondo la legge di Lambert-Beer, esiste una relazione tra assorbimento e spessore dello strato. In questo modo è possibile calcolare i valori di assorbimento per i diversi spessori di strato (da 0,04 mm a 2 mm). Gli spessori ridotti agiscono come una diluizione virtuale del campione, ma possono essere utilizzati solo a concentrazioni corrispondentemente più elevate. Pertanto, spesso è possibile rinunciare completamente alla diluizione manuale del campione.
Costruzione di uno spettrometro UV / VIS a matrice di diodi
Un'altra tecnologia è la tecnologia a serie di diodi. Il campione nella cuvetta viene irradiato con un raggio di luce costituito dalla gamma di lunghezze d'onda continue della sorgente luminosa (ad es. Lampada flash allo xeno , da 190 nm a 1100 nm). Durante una misurazione, il campione assorbe diverse lunghezze d'onda dalla sorgente di luce. La luce non assorbita passa attraverso la fessura d'ingresso e viene suddivisa in un reticolo di diffrazione in base alla sua lunghezza d'onda. Lo spettro viene rilevato con l'aiuto di un sensore CCD e quindi valutato. Nel caso di dispositivi non automatici, deve essere misurato anche il campione di riferimento. I vantaggi della tecnologia sono tempi di misurazione brevi, poiché l'intero spettro UV / VIS può essere registrato con una misurazione, bassi costi di manutenzione, poiché non ci sono componenti mobili nello spettrometro e che i dispositivi possono essere costruiti in modo compatto.
Esempi chimici
Le transizioni da π a π * sono utili per gli idrocarburi insaturi ( ad es. Alcheni ). Sono realizzati utilizzando luce UV a onde più lunghe e sono facili da misurare. Si ottengono informazioni sulla lunghezza d'onda di assorbimento della molecola, sulla sua struttura e sul colore . L'assorbimento della luce avviene nel campo delle onde più lunghe, maggiore è il numero di doppi legami coniugati . Se l'energia delle transizioni da π a π * è nell'intervallo della luce visibile, la molecola appare colorata. Assume sempre il colore complementare della luce che assorbe.
Le seguenti regole di selezione devono essere sempre osservate per le transizioni di elettroni in esame (inclusa la regola di Laporte ):
- Regola di rotazione: la rotazione totale deve essere mantenuta
- Le transizioni tra diversi moltiplicatori di giri sono proibite. L'eccitazione è consentita solo se lo spin totale della molecola non cambia, cioè se è presente lo stesso numero di elettroni accoppiati e spaiati (spin) prima e dopo l'eccitazione.
- Divieto di transizioni a parità di parità (divieto Laporte)
Nel caso del divieto di Laporte, devono essere fatte due domande secondo la teoria del campo del ligando.
- La molecola ha un centro di inversione? Se è così (ad esempio un ottaedro), per il momento non è consentita un'eccitazione. In caso contrario (ad esempio un tetraedro), l'eccitazione è consentita.
- La parità (segno) degli orbitali cambia? In tal caso, l'eccitazione è consentita (ad esempio la transizione da s → p orbitale). In caso contrario, l'eccitazione non è consentita (ad esempio la transizione da p → f orbitale). Una transizione può avvenire solo da pari a dispari o da dispari a pari (gli orbitali se d sono pari, gli orbitali pe f sono dispari).
Per esempio.:
- La transizione 3s → 4s è vietata
- è consentita la transizione 3s → 4p
Avvertenza: Vietato non significa che queste transizioni non si verifichino! Il colore debole dei complessi è causato dalle vibrazioni dei ligandi rispetto al centro metallico. Di conseguenza, la simmetria di inversione, che era importante nel divieto di Laporte, viene temporaneamente annullata e può aver luogo una transizione.
Guarda anche
link internet
- Elenco delle banche dati e delle opere di riferimento dell'ETH di Zurigo con spettri UV / VIS
- White paper di Mettler-Toledo: Spettrometri UV / VIS a confronto: serie di diodi contro tecnologia di scansione
Prove individuali
- ↑ Manfred Reichenbächer, Jürgen Popp: [ anteprima limitata nell'analisi della struttura di ricerca di Google libri di composti organici e inorganici: un quaderno] . Springer Science & Business Media, 25 settembre 2007, ISBN 978-3-8351-0190-6 , p. 119.
- ^ Christopher G. Morris, Academic Press: Dizionario Academic Press di scienza e tecnologia . Gulf Professional Publishing, 1992, ISBN 0-12-200400-0 , pagg. 716 ( anteprima limitata nella ricerca di Google Libri).
- ↑ Collettivo di autori, autori principali: K. Doernel, R. Geyer: Analytikum - Metodi di chimica analitica e loro fondamenti teorici . 8a edizione. Casa editrice tedesca VEB per l'industria di base, Lipsia 1990, ISBN 3-342-00191-7 , p. 259 ff .
- ↑ H. Stranneheim, J. Lundeberg: Stepping stones in DNA sequencing. In: rivista di biotecnologia. Volume 7, numero 9, settembre 2012, ISSN 1860-7314 , pagg. 1063-1073, doi: 10.1002 / biot.201200153 , PMID 22887891 . PMC 3472021 (testo completo gratuito).
- ^ PO Michel, C. Degen, M. Hubert, L. Baldi, DL Hacker, FM Wurm: un metodo basato su NanoDrop per la determinazione rapida del declino della vitalità nelle colture in sospensione di cellule animali. In: Biochimica analitica. Volume 430, numero 2, novembre 2012, ISSN 1096-0309 , pagg. 138-140, doi: 10.1016 / j.ab.2012.08.028 , PMID 22960013 .
- ↑ MT Kelliher, MS Piraino, ME Gemoules, CA Southern: un confronto tra gli approcci di analisi del trasferimento di energia di risonanza di Förster per la fluorometria Nanodrop. In: Biochimica analitica. Volume 441, numero 1, ottobre 2013, ISSN 1096-0309 , pp. 44-50, doi: 10.1016 / j.ab.2013.06.009 , PMID 23811157 .
- ^ Owen T.: Fondamenti della moderna spettroscopia UV-visibile: un primer . 1996.
- ↑ Joseph B. Lambert, Scott Gronert, Herbert F. Shurvell, David A. Lightner: Spectroscopy - Structure Clarification in Organic Chemistry 2nd Edition, Pearson Germany, Monaco 2012, ISBN 978-3-86894-146-3 , p. 591 - 653.