ammonio

Lo ione ammonio NH 4 + ( anche ione azanio secondo IUPAC ) è un catione che forma sali con anioni simili agli ioni di metalli alcalini . È l' acido coniugato all'ammoniaca di base (NH 3 ). Esempi di sali di ammonio sono nitrato di ammonio (NH 4 NO 3 ) o cloruro di ammonio (NH 4 Cl).
Nei sali organici di ammonio, l'atomo di azoto ha anche quattro partner leganti e una carica formale positiva. Tuttavia, almeno un radicale organico è legato all'atomo di azoto, come per. B. in cloridrati .
proprietà
Uno ione ammonio ha una struttura tetraedrica . L'ammonio forma un equilibrio di dissociazione con l' ammoniaca . A causa della partecipazione di uno ione ossonio , questo equilibrio dipende dal valore del pH . La proporzione di ammoniaca aumenta con l'aumentare del valore del pH e l'aumento della temperatura.
Il pK s valore di ammonio è 9.2. I sali di ammonio (ad es. Solfato di ammonio ) reagiscono in soluzione acquosa come acidi deboli e quindi formano soluzioni leggermente acide.
L' atomo di azoto nell'ammonio può essere ossidato in azoto in modo relativamente semplice. Un tipico esempio di ciò è la decomposizione termica del bicromato di ammonio .
In letteratura, i sali di ammonio sono spesso descritti come sali pseudo- alcalini, che risultano dalle loro proprietà paragonabili ai sali di metalli alcalini. Questa analogia può essere spiegata principalmente da un raggio ionico quasi identico e dalla stessa carica. Soprattutto sono simili ai sali alcalini per la loro solubilità in acqua.
- Vedi anche: Teorema di spostamento dell'idruro di Grimm
Ammonio in natura
In natura, l'ammonio si forma principalmente quando le proteine si disgregano. Viene utilizzato dai pesci e dalla maggior parte degli altri organismi acquatici come prodotto finale, ad es. B. attraverso le branchie, escreto. Viene anche rilasciato come prodotto finale quando la biomassa morta viene decomposta dai batteri. Svolge un ruolo importante nel ciclo dell'acido citrico , in cui reagisce con l' α-chetoglutarato per formare l' acido glutammico .
L'ammonio viene prima ossidato in nitrito dai batteri (incluso Nitrosomonas ) nel suolo e nell'acqua con il consumo di ossigeno e poi ulteriormente ossidato in nitrato da un altro tipo di batteri (incluso Nitrobacter ) e quindi "disintossicato". Oltre ai batteri, anche gli archaea svolgono un ruolo importante nell'ossidazione dell'ammoniaca nel suolo. Questo processo è chiamato nitrificazione ed è molto desiderabile nel terreno. La nitrificazione è anche una parte importante dell'autopulizia nei corpi idrici .
L'ammoniaca è tossica per i pesci anche a basse concentrazioni. I livelli di ammonio nell'acqua da 0,5 a 1 mg / l sono quindi classificati come pericolosi per i pesci , a seconda del valore di pH dell'acqua. Se il contenuto di ammonio supera 1 mg / l, un corpo idrico non è adatto alla pesca.
Importanza fisiologica
Lo ione ammonio è simile allo ione potassio (K + ) sia per dimensioni che per carica e può quindi prendere il suo posto nell'organismo. Ma poiché reagisce in modo diverso, ad es. B. le sinapsi controllate dal potassio non possono essere nuovamente separate, le bloccano in modo permanente. Quindi funziona in tutti gli organismi con sinapsi controllate dal potassio come veleno per i nervi .
L'ammonio nelle urine indica il tartaro .
Nei mammiferi, l'ammonio viene convertito in urea non tossica attraverso il ciclo dell'urea nel fegato e in parte nei reni ed escreto attraverso i reni. Negli uccelli e nelle lucertole che vivono sulla terra, l'acido urico viene invece prodotto ed escreto. I pesci non necessitano di alcuna conversione dell'ammoniaca; nel loro caso, la pelle a diretto contatto con l'acqua offre la semplice via dell'osmosi .
uso
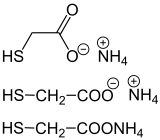
| Sale di ammonio dell'acido tioglicolico in tre formule |
I sali di ammonio sono i composti più importanti nell'industria chimica inorganica. Sono prodotti su scala megaton e sono utilizzati principalmente come fertilizzanti e, in misura minore, in batterie a secco e coloranti.
Il sale di ammonio dell'acido tioglicolico viene utilizzato come agente riducente nell'onda permanente . Il sale di ammonio dell'acido tiolattico è un altro esempio della chimica organica ed è utilizzato anche nel settore dell'acconciatura.
prova
Per testare ( pre-test ) una sostanza per l'ammonio, viene miscelata con un po 'di soda caustica o idrossido di sodio . L'ammoniaca rilasciata può essere odorata oppure può essere rilevata dallo scolorimento di base di una striscia reattiva a pH umido sopra la miscela di reazione ( corrispondenza incrociata ).
Una prova sensibile è la reazione con il reagente di Nessler , che, tuttavia, risponde anche alle ammine . Una determinazione quantitativa sensibile e selettiva avviene secondo DIN principalmente con l' aiuto della reazione di Berthelot con la formazione di un indofenolo blu , la cui concentrazione può essere misurata colorimetricamente .
Chimica organica
Cloruro di tetrametilammonio e trietilammina - cloridrato sono esempi di sali di ammonio organico, in cui l'atomo di azoto contiene anche quattro partner di legame, tuttavia, questi radicali organici o parzialmente sono atomi di idrogeno, come in cloridrati, bromidrati o Hydroiodiden .
Prove individuali
- ^ GJ Leigh (ed.): Principles of chemical nomenclature. Una guida alle raccomandazioni IUPAC. The Royal Society of Chemistry, Cambridge 2011, p. 46.
- ↑ a b M. Binnewies et alii: Allgemeine und Anorganische Chemie. 2a edizione. Spectrum, 2010, ISBN 3-8274-2533-6 . P. 478s.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Textbook of Inorganic Chemistry . 101a edizione. Walter de Gruyter, Berlino 1995, ISBN 3-11-012641-9 , p. 654.
- ↑ Scinexx.de: batteri primordiali come "ammonium killer" , accesso 31 gennaio 2013.
- ↑ Robert Guderian (a cura di): Manuale di cambiamenti ambientali ed ecotossicologia - Volume 1A , Springer, Berlino 2000, ISBN 978-3-540-66184-9 .
- ↑ Wolfgang Legrum: Fragrances, between stink and fragrances , Vieweg + Teubner Verlag (2011) p. 165, ISBN 978-3-8348-1245-2 .
- ^ E. Schweda: Jander / Blasius: Inorganic Chemistry I - Introduzione e analisi qualitativa. 17a edizione. Hirzel, 2012, ISBN 978-3-7776-2134-0 . P. 294.